(12分)对二甲苯(英文名称p-xylene,缩写为PX)是一种低毒化合物,也是聚酯工业的重要原料,主要用于生产对苯二甲酸(PTA),对苯二甲酸再和乙二醇(EG)反应生成聚对苯二甲酸乙二醇酯(PET)。国内对二甲苯产量增长步伐放缓,供应缺口加大,近一半的PX依靠进口。以PX为主要原料生产PET的一种路线如下:
(1)PX可以发生的反应类型有加成反应、 、 。(填反应类型)
(2)PX的核磁共振氢谱有 组峰,峰面积之比为 。
(3)反应②的化学方程式为 。(不用注明条件)
(4)PX的来源之一是煤的干馏。已知煤干馏副产物煤焦油主要成分有苯、甲苯、混合二甲苯、酚类等,从煤焦油中分离提纯对二甲苯的方法是 。
(5)“甲苯甲醇烷基化”制备对二甲苯是一条增产PX的新工艺路线:
写出该反应的化学方程式: 。(不用注明条件)
(6)PTA的一种同分异构体X与其含有相同官能团,且其苯环上的一氯取代物有两种,写出化合物X 与1,3-丙二醇1:1形成最简单环酯的结构简式: 。
某酸是一种常见的有机酸,其结构为: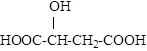
(1)此有机酸含有的官能团名称是____________;在一定条件下,此有机酸可发生化学反应的类型有 ________(填序号);
| A.水解反应 |
| B.取代反应 |
| C.加成反应 |
| D.消去反应 |
E.加聚反应
F.中和反应
(2)下列物质与此酸互为同分异构体的是_____________(填序号);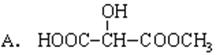
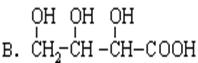

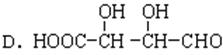
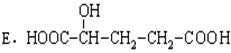
(3)写出此有机酸与足量的金属钠发生反应的化学方程式:__________________________;
松油醇是一种调香香精,它是α、β、γ三种同分异构体组成的混合物,可由松节油分馏产品A(下式中18是为区分两个羟基而人为加上去的)经下列反应制得:
(1)A的分子式为__________________。
(2)γ松油醇的结构简式为_________________。
(3)α松油醇能发生的反应类型是________________(填代号)。
a.加成反应
b.水解反应
c.氧化反应
d.消去反应
e.取代反应
(4)在许多香料中松油醇还有少量以酯的形式出现,写出CH3COOH和α松油醇反应的化学方程式____________________________________________________。
【化学---选修5有机化学基础】15分
已知两个羟基同时连在同一个碳原子上时结构是不稳定的,它将发生脱水反应,例如:CH3CH(OH)2→CH3CHO +H2O,现有分子式为C9H8O2Br2的物质M,已知E的化学式为C7H5O2Na,A的相对分子质量为46,在一定条件下可发生下列一系列反应:
请回答下列问题
(1)B中官能团的名称 ,A的核磁共振氢谱有 个吸收峰;G→H的反应类型 。
(2)M的结构简式
(3)写出下列反应的化学方程式
①A→B ②H→I
(4)同时符合下列条件的G的同分异构体的结构简式有 种,写出其中一种的结构简式
| A.分子中含有苯环 | B.能发生水解反应 |
| C.能发生银镜反应 | D.与FeCl3溶液反应显紫色 |
(1)只用一种试剂(可加热)就可区别下列五种无色液体:CH3CH2CH2OH、CH3CH2CHO、HCOOH、CH3COOH、CH3COOCH2CH3,该试剂可以是 。
(2)①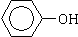 ②CH2=CH2 ③CH≡CH ④
②CH2=CH2 ③CH≡CH ④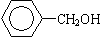
⑤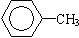 ⑥
⑥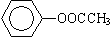 ⑦CH3CH2CH2CH2Br
⑦CH3CH2CH2CH2Br
上述有机物中(填写上述物质的序号)
①属于芳香烃的是 ;
②能与溴水发生加成反应的是 ;
③能发生消去反应的是 ;
④能与NaOH溶液反应,但不能与Na2CO3溶液反应的是 。
(10分,每空2分)A、B、C、D是四种短周期元素,它们的原子序数依次增大。其中A、D元素同主族且A是原子半径最小的元素,B、C元素同周期,B的最外层电子数是次外层电子数的2倍;由A、B、C、D中的两种元素可形成原子个数比为1:1的多种化合物,甲、乙、丙为其中的三种,它们的元素组成如下表所示:
| 化合物 |
甲 |
乙 |
丙 |
| 组成元素 |
B、C |
A、C |
C、D |
常温下,甲物质为气体,密度略小于空气;乙物质为液体;丙物质为固体且为离子化合物。请填写下列空白:
(1)乙的化学式为 ,丙物质的化学式为 ,其中丙中阴离子与阳离子的个数之比为 。
(2)某同学设计了一个CH3OH燃料电池,并用该电池电解200mL一定浓度的NaCl与CuSO4的混合溶液,其装置如下图:
①写出ⅰ中通入甲醇这一极的电极反应式 。
②理论上ⅱ中两极所得气体的体积随时间变化的关系如坐标图所示(气体体积已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式 。
分子式为C4H10O的有机化合物A。按要求完成下列问题:(每空1分,共5分)
(1)若A能在催化剂作用下连续氧化生成羧酸,请写出它可能的结构简式为 、 。
(2)当C原子与4个不同的原子或基团相连时该碳原子称作“手性”碳原子。则分子式为C4H10O的有机化合物中,含有“手性”碳原子的结构简式为________________。
(3)A(C4H10O) B(C4H8),已知:A分子中有三个甲基。A与浓HBr溶液一起共热生成H
B(C4H8),已知:A分子中有三个甲基。A与浓HBr溶液一起共热生成H
写出A、H的结构简式 、
汽油(假设其成分以辛烷计)中加入一定比例的乙醇能提高汽油的燃烧效率,节约能源、减少污染。
(1)加入一定比例乙醇的汽油完全燃烧,比等质量的未加乙醇的汽油完全燃烧,所消耗O2的物质的量 (选填“大”、“小”、“相等”)。
(2)若取22.8 g未加乙醇的汽油,使之完全燃烧,产生的CO2在标准状况下的体积为 。
(3)若取50.2 g掺入乙醇的汽油,与足量O2反应,测得生成CO2的质量为149.6 g。计算所取汽油中乙醇的物质的量是多少?
(10分)未知物A的实验式和分子式都是C2H6O。A的红外光谱图如图(a),未知物A的核磁共振氢谱有三个峰图(b),峰面积之比是1∶2∶3。

(1)未知物A的结构简式为________。
(2)未知物A________(“能”或“不能”)萃取碘水中的碘。
(3)在质谱图中,A的最大质荷比是________。
(4)A中________(“有”或“没有”)手性碳原子。
(5)根据“基团理论”, A中的基团名称是________。
乙醇汽油作为一种新型清洁燃料,是目前世界上可再生能源的发展重点,而且具有较好的经济效益和社会效益,终将成为汽油和柴油的替代品。
(1)写出乙醇完全燃烧的化学方程式:______________________________。
(2)乙醇燃烧时如果氧气不足,可能还有CO生成。用如图装置验证乙醇的燃烧产物中有CO、CO2、H2O,应将乙醇的燃烧产物依次通过(按气流从左到右的顺序填装置编号)________。
(3)实验时可观察到装置②中A瓶的石灰水变浑浊。A瓶溶液的作用是________________;B瓶溶液的作用是________________;C瓶溶液的作用是_________________________。
(4)装置③的作用是________________;装置①中所盛放的是________________,作用是_______________________________________。
(5)装置④中所盛的固体药品是______________,它可以验证的产物是_____________。
(6)尾气应如何处理?___________________。
(7)海底有大量的甲烷水合物。等质量的甲烷和乙醇完全燃烧产生温室气体CO2较多的是________。
(共16分)A、B、C、D四种化合物,有的是药物,有的是香料。它们的结构简式如下所示:
(1)化合物A的分子式是 ;A中含有的官能团的名称是 ;
(2)A、B、C、D四种化合物中互为同分异构体的是(填序号) ;
(3)化合物B的核磁共振氢谱中出现 组峰;
(4)1mol D最多能与 mol的氢气发生加成反应;1mol D与足量Br2水混合,最多能和 mol Br2发生反应;
(5)A与乙二醇(HOCH2CH2OH)以物质的量2:1反应生成一种酯和水,请写出该反应的化学方程式(注明反应条件): 。
(6)已知C的一种同分异构体满足:①能够发生水解反应;②能够发生银镜反应;③能够使FeCl3溶液显紫色;④苯环上的一氯代物有2种。请写出它的结构简式 。
1mol分子组成为C3H8O的液态有机物A,与足量的金属钠作用,可生成11.2 L氢气(标准状况),则A分子中必有一个___基,若此基在碳链的一端,则A的结构简式为 。A与浓硫酸共热,分子内脱去1分子水,生成B,反应的方程式为 ;B通入溴水能发生________反应,反应的方程式为 。
现有分子式都是C7H8O的芳香族化合物A、B、C三种物质。若各取少许分别滴加FeCl3溶液,只有C呈紫色;若投入金属钠,只有B无明显变化。
(1)写出A、B的结构简式______。
(2)C有多种同分异构体,若其一溴代物最多有两种,C的这种同分异构体的结构简式为________。
Ⅰ.乙醇是重要的有机化工原料,可由乙烯气相直接水合法或间接水合法生产。
(1)间接水合法是指先将乙烯与浓硫酸反应生成硫酸氢乙酯C2H5OSO3H),再水解生成乙醇。写出相应反应的化学方程式:_________________________________。
(2)已知:
甲醇脱水反应 2CH3OHg) === CH3OCH3g) + H2Og) △H1="=" -23.9 kJ·mol—1
甲醇制烯烃反应 2CH3OHg) === C2H4g) + 2H2Og) △H2="=" -29.1 kJ·mol—1
乙醇异构化反应 C2H5OHg) === CH3OCH3g) △H3== + 50.7 kJ·mol—1[来源:Z_xx_k.Com]
则乙烯气相直接水合反应C2H4g) + H2Og)=== C2H5OHg)的△H == __________________________。与间接水合法相比,气相直接水合法的优点是__________________________________。
Ⅱ. 甲醇虽然毒性很强,但它是一种清洁燃料,也是一种重要的合成原料。工业甲醇的质量分数可以用下列方法测定:
①在稀硫酸中甲醇被Cr2O72-氧化成CO2和H2O,其反应为:
CH3OH + Cr2O72— + 8H+==== CO2↑+ 2Cr3++ 6H2O;
②过量的Cr2O72—可用Fe2+与之完全反应,反应如下所示:
____Cr2O72— + ____Fe2+ +____H+――― ____Cr3++____Fe3+ +____H2O
现有0.12 g工业甲醇,在稀硫酸中与25.0 mL 0.2 mol/L K2Cr2O7溶液反应,多余的K2Cr2O7恰好与9.6 mL 1.0 mol/LFeSO4溶液完全反应。
(3)请配平第②步中离子方程式配平系数依次填写在短线上)。
(4)工业甲醇的质量分数为__________。
(5分)有机物A的结构简式为 ,它可通过不同化学反应分别制得B、C、D和E四种物质。
,它可通过不同化学反应分别制得B、C、D和E四种物质。
请回答下列问题:
(1)写出有机物A中官能团的名称: 、 。
(2)在A~D四种物质中,与E互为同分异构体的是 (填代号)。
(3)写出有机物C发生加聚反应生成高分子化合物的化学方程式 。
试题篮
()