太阳能电池的发展已经进入了第三代。第一代为单晶硅太阳能电池,第二代为多晶硅、非晶硅等太阳能电池,第三代就是铜铟镓硒CIGS(CIS中掺人Ga)等化合物薄膜太阳能电池以及薄膜Si系太阳能电池。
(1)镓的基态原子的电子排布式是___ 。
(2)硒为第4周期元素,相邻的元素有砷和溴,则3种元素的第一电离能从大到小顺序为 (用元素符号表示)。
(3)H2Se的酸性比H2S____(填“强”或“弱”)。气态SeO3分子的立体构型为____ 。
(4)硅烷(SinH2n+2)的沸点与其相对分子质量的变化关系如图所示,呈现这种变化关系的原因是 。
(5)与镓元素处于同一主族的硼元素具有缺电子性,其化合物往往具有加合性,因而硼酸(H3BO3)在水溶液中能与水反应生成[B(OH)4]—而体现一元弱酸的性质,则[B(OH)4]—中B的原子杂化类型为 。
(6)金属Cu单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,其原因是____,反应的离子方程式为 。
(7)一种铜金合金晶体具有面心立方最密堆积的结构。在晶脆中,Au原子位于顶点,Cu原子位于面心,则该合金中Au原子与Cu原子个数之比为 ,若该晶胞的边长为a pm,则合金的密度为 g·cm-3(已知lpm=10-12m,只要求列算式,不必计算出数值,阿伏加塞罗常数为NA)。
锂—磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:
2Na3PO4+4CuSO4+2NH3·H2O=Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O
(1)写出基态Cu2+的核外电子排布式: 。
(2)PO43—的空间构型是 。
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。N2H4分子中氮原子轨道的杂化类型是 。
(4)胆矾CuSO4·5H2O的结构示意图如下,其含有的微粒间作用力有 。(填序号)
a.离子键 b.极性键 c.金属键
d.配位键 e.氢键 f.非极性键
(5)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,则1 mol CN-中含有的π键的数目为 。
(6)Cu元素与H元素可形成一种红色化合物,其晶体结构单元如图所示。则该化合物的化学式为 。 
根据元素周期表中第四周期元素的相关知识,回答下列问题:
(1)第四周期元素的基态原子的电子排布中4s轨道上只有1个电子的元素有________种;写出Cu+的核外电子排布式________。
(2)按电子排布,可将周期表里的元素划分成五个区域,第四周期元素中属于s区的元素有________种,属于d区的元素有________种。
(3)CaO晶胞如右图所示,CaO晶体中Ca2+的配位数为________;CaO的焰色反应为砖红色,许多金属或它们的化合物都可以发生焰色反应,其原因是________________
(4)由叠氮化钾(KN3)热分解可得纯N2:2KN3(s)=2K(l)+3N2(g),下列有关说法正确的是________(填选项字母)。
| A.NaN3与KN3结构类似,前者晶格能较小 |
B.晶体钾的晶胞结构如图所示: ,每个晶胞中分摊2个钾原子 ,每个晶胞中分摊2个钾原子 |
| C.氮的第一电离能大于氧 |
| D.氮气常温下很稳定,是因为氮的电负性小 |
(5)二氧化钛(TiO2)是常用的、具有较高催化活性和稳定性的光催化剂。O2在其催化作用下,可将CN-氧化成CNO-。CN-的电子式为_______,CNO-的中心原子的杂化方式为_______
(6)在CrCl3溶液中,一定条件下存在组成为[CrCln(H2O)6-n]x+(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:[CrCln(H2O)6-n]x++xR-H Rx[CrCln(H2O)6-n]+xH+。将含0.0015 mol[CrCln(H2O)6-n]x+的溶液,与R-H完全交换后,中和生成的H+需浓度为0.1200 mol·L-1 NaOH溶液25.00 mL,则该配离子的化学式为_______。
Rx[CrCln(H2O)6-n]+xH+。将含0.0015 mol[CrCln(H2O)6-n]x+的溶液,与R-H完全交换后,中和生成的H+需浓度为0.1200 mol·L-1 NaOH溶液25.00 mL,则该配离子的化学式为_______。
决定物质性质的重要因素是物质结构。请回答下列问题。
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示: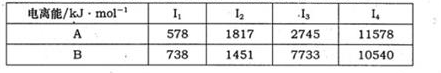
A通常显 价,A的电负性 B的电负性(填“>”、“<”或“=”)。
(2)紫外光的光子所具有的能量约为399kJ·mol-1。根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因: 。组成最简单氨基酸碳原子杂化类型是______________________。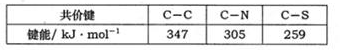
(3)实验证明:KC1、MgO、CaO、TiN这4种晶体的结构与NaC1晶体结构相似(如图所示),已知3种离子晶体的晶格能数据如下表:则该4种离子晶体(不包括NaC1)熔点从高到低的顺序是: 。其中MgO晶体中一个Mg2+周围和它最邻近且等距离的是Mg2+有 个。 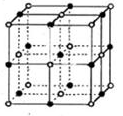

(4)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是 。
(5)某配合物的分子结构如图所示,其分子,内不含有 (填序号)。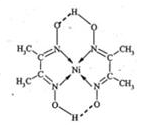
| A.离子键 | B.极性键 |
| C.金属键 | D.配位键 |
E.氢键 F.非极性键
A、B、C、D、E、F、G是原子序数依次增大的七种元素,其中A、B、C、D、E为短周期元素, F、G为第四周期元素。已知:A是原子半径最小的元素,B、C、D是紧邻的三个族的元素,C的三价阴离子和E的二价阳离子具有相同的电子层结构,F元素的基态原子具有六个成单电子,G是ⅠB族的元素。回答下列问题:
(1)写出E、F、G的元素符号 ,B、C、D元素的第一电离能由大到小的顺序是 (用元素符号表示),A元素分别与B、D元素形成的二种微粒都具有NH3相似的结构,属于等电子体,它们的化学式是 。
(2)F元素的原子基态价层电子排布图是 。
(3)向G的硫酸盐溶液中滴加氨水会生成蓝色沉淀,继续滴加氨水至沉淀刚好全部溶解时可得到蓝色溶液,继续向其中加入极性较小的乙醇可以生成深蓝色的[G(NH3)4]SO4·H2O沉淀。该深蓝色沉淀中的NH3通过________键与中心离子G2+结合;NH3分子中N原子的杂化方式是________;
(4)E单质晶体中原子的堆积模型如右图,晶胞是图中的 (填a、b或c);配位数是 ;若紧邻的四个E原子的中心连线构成的几何体的体积是a cm3,E单质的密度为ρg/ cm3;则E的相对原子质量的计算式是 。
我国部分城市灰霾天占全年一半,引起灰霾的PM2.5微细粒子包含(NH4)2SO4、NH4NO3,有机颗粒物及扬尘等。通过测定灰霾中锌等重金属的含量,可知目前造成我国灰霾天气主要是交通污染。
(1)Zn2+在基态时核外电子排布式为____ _。
(2)SO42-的空间构型是___ __(用文字描述)。
(3)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾污染,光化学烟雾中含有NOX、O3、CH2="CH-CHO," HCOOH, CH3COOONO2(PAN)等二次污染物。
①下列说法正确的是___ __(不定项选择)。
a.N2O结构式可表示为N=N=O
b.O3分子呈直线形
c.CH2=CH-CHO分子中碳原子均采用sp2杂化
d.相同压强下,HCOOH沸点比CH3OCH3高,说明前者是极性分子,后者是非极性分子
②1mo1PAN中含σ键数目为_____。
③NO能被FeS04溶液吸收生成配合物[(Fe(NO)(H20)5)S04,该配合物中心离子的配位数为_____(填数字)。
(4)测定大气中PM2.5的浓度方法之一是β一射线吸收法,β一射线放射源可用85Kr,已知Kr晶体的晶胞结构如图所示,设晶体中与每个Kr原子相紧邻的Kr原子有m个,晶胞中含Kr原子为n个,则m/n=_____(填数字)。
下表为长式周期表的一部分,其中的序号代表对应的元素。
(1)在元素③与①形成的水果催熟剂气体化合物中,元素③的杂化方式为 杂化, 键与
键与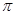 键的个数比为 。
键的个数比为 。
(2)元素③、④、⑤、⑥的第一电离能由大到小的顺序为 。其中⑥元素核外电子的电子排布图为 。
(3)③元素形成的最高价氧化物所形成的晶胞边长为acm,则其晶胞密度为 ;
(4)元素④的最高价氧化物对应的水化物稀溶液与元素⑦的单质反应时,还原产物没有气体,该反应的离子方程式为 。
(5)元素③与⑤形成的原子个数比为1:1化合物能与⑩的单质形成形式为A(BC)5的配合物,该配合物常温下为液态,易溶于非极性溶剂,其晶体类型 ,该配合物在一定条件下分解生成⑩的单质和③与⑤形成的原子个数比为1:1化合物,则在分解过程中破坏的化学键为 ,形成的化学键为 。
(6)化学上有一种见解,认为同种元素形成的含氧酸中该成酸元素的化合价越高,酸性越强,请用表中的元素举例说明(酸性由强到弱的顺序) 。
金属铜广泛地应用于电气、机械制造、国防等领域。
(1)Cu是元素周期表中第29号元素,写出第三周期基态原子未成对电子数与Cu相同且电负性最大的元素是 (填元素名称)。
(2)CuO受热易分解为Cu2O和O2,请从铜的原子结构来说明CuO受热易分解的原因:
。
(3)下图是铜的某种氧化物的晶胞示意图。已知该晶胞的边长为a cm,阿伏加德罗常数为NA,该晶体的密度为 。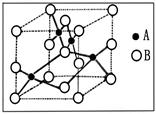
(4)向硫酸铜溶液中滴加氨水会生成蓝色沉淀,在滴加氨水到沉淀刚好全部溶解可得到深蓝色溶液,继续向其中加入极性较小的乙醇可以生成深蓝色的[Cu(NH3)4]SO4·H2O沉淀。
①SO42-中S原子的杂化方式为 。
②NH3分子内的H—N—H键角 (填“大于”“等于”或“小于”)H2O分子内的H—O—H键角。
③S、N、O三种元素第一电离能由大到小的顺序为 。
纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域。单位质量的A和B单质燃烧时均放出大量热,可用作燃料。巳知A和B均为短周期元素,其原子的第一至第四电离能如下表所示: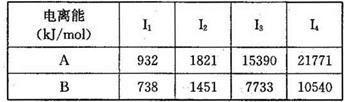
(1)某同学根据上述信息,推断B的核外电子排布如图所示,该同学所画的电子排布图违背了_______。
(2)ACl2分子中A的杂化类型为_______。
(3)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。已知金刚石中的C—C的键长为154.45pm,C60中C—C键长为145〜140pm,有同学据此认为C60的熔点高于金刚石,你认为此说法是否正确_______ (填“正确”或“不正确”),并阐述理由。
(4)科学家把C60和钾掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示,该物质在低温时是一种超导体。写出基态钾原子的价电子排布式 ,该物质中K原子和C60分子的个数比为_______。
(5)继C60后,科学家又合成了Si60、N60,C、Si、N原子电负性由大到小的顺序是_______,NCl3分子的价层电子对互斥理论模型为_______。Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足 8电子稳定结构,则分子中π键的数目为_______
现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题.
| A原子核外电子分占3个不同能级,且每个能级上排布的电子数相同 |
| B元素原子的核外p电子总数比s电子总数少1 |
| C原子p轨道上成对电子数等于未成对电子数,且与A同周期 |
| D元素的族序数与周期数的差为4,且不与A元素在同一周期 |
| E位于周期表中第七列 |
| F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子 |
(1)A的基态原子最外层有 种不同运动状态的电子,F位于 区。
(2)E2+的基态核外电子排布式为 ,AD4为 (填极性或非极性)分子。
(3)A、B、C三种元素的电负性由小到大的顺序是 (用元素符号表示),B和C两元素中,B的第一电离能较大的原因是 ,与AC2互为等电子体的分子的名称为 。(只写一种)
(4)BD3 中心原子的杂化方式为 ,其分子空间构型为 。
(5)用晶体的x射线衍射法对F的测定得到以下结果:F的晶胞为面心立方最密堆积(如图),又知该晶体的密度为ρg/cm3,晶胞中该原子的配位数为 ;F的原子半径是 pm;(阿伏加德罗常数为NA)。
铜单质及其化合物在很多领域有重要的用途,如超细铜粉可应用于导电材料、催化剂等领域中。超细铜粉的某制备方法如下:
(1)[Cu(NH3)4]SO4中,N、O、S三种元素的第一电离能从大到小的顺序为: 。
(2) SO42-中硫原子的杂化轨道类型是 :写出一种与SO42-互为等电子体的分子 。
(3)某反应在超细铜粉做催化剂作用下生成 ,则分子中 σ 键与 π 键之比为 。
,则分子中 σ 键与 π 键之比为 。
(4)该化合物[Cu(NH3)4]SO4中存在的化学键类型有 。(填字母)
| A.离子键; | B.金属键; | C.配位键; | D.非极性键;E.极性键 |
(5)NH4CuSO3中的金属阳离子的核外电子排布式为 。
(6)铜的某氯化物的晶胞结构如图所示,该化合物的化学式为 。
请回答下列问题:
(1)下列现象和应用与电子跃迁无关的是________________________________。
A.激光 B.焰色反应 C.原子光谱 D.燃烧放热 E.石墨导电
(2)A、B两种短周期元素,A是原子半径最小的元素,B原子最外层电子数是次外层的两倍。某平面正六边形分子由A、B两种元素组成且原子个数比为1:1,该分子中含有_______个σ键。
(3)元素铬化合物(CrO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。
①与铬同周期的基态原子中最外层电子数与铬原子相同的元素有___________(填元素符号)
②在a:苯 b:CH3OH c:HCHO d:CS2 e:CCl4 五种有机溶剂中,碳原子采取sp3杂化的分子有___________(填字母),CS2分子的键角是__________。
③过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般地,为d0或d10排布时,无颜色;为d1~d9排布时,有颜色,如[Co(H2O) 6]2+显粉红色。据此判断,[Mn(H2O) 6]]2+ _____________(填“无”或“有”)颜色
(4) 请写出HClO的电子式:_______________________;在下图配合物离子[Cu(NH3)4]2+.中的画出配位键:
(5) A、B均为短周期金属元素。依据下表数据和已学知识,
| 电离能/KJ·mol-1 |
I1 |
I2 |
I3 |
I4 |
| A |
932 |
1821 |
15390 |
21771 |
| B |
738 |
1451 |
7733 |
10540 |
判断金属B的价电子电子排布式______,写出金属B与二氧化碳反应的化学方程式: _______________________________________________。
A、B、C、D、E、F为原子序数依次增大的短周期元素,B、C相邻且同周期,A、D同主族。A、C能形成两种化合物甲和乙,原子个数比分别为2∶1和1∶1,甲为常见的溶剂。E是地壳中含量最多的金属元素。F元素为同周期电负性最大的元素。D和F可形成化合物丙,E和F可形成化合物丁。G为第四周期未成对电子数最多的元素
请回答下列问题:
(1)写出G基态原子的外围电子排布式 。
(2)B和C比较,第一电离能较大的元素是 (填元素符号),其原因为 。
(3)甲、乙两分子中含有非极性共价键的是 (填分子式)。
(4)已知化合物丁熔点190℃,沸点183℃,结构如图所示。
①丙和丁比较,熔点较低的化合物是 (填化学式),其原因为 。
②则丁晶体中含有的作用力有 (填序号)。
A.离子键 B.共价键 C.金属键 D.配位键 E.范德华力
(5)G3+与元素A、C、F构成配合物戊,在含有0.001mol戊的溶液中加入过量AgNO3溶液,经过滤、洗涤、干燥后,得到287mg白色沉淀。已知该配合物的配位数为6,则戊的化学式为 。
(6)三聚氰胺(结构如图)由于其含氮量高被不法奶农添加到牛奶中来“提高”蛋白质的含量,造成全国许多婴幼儿因食用这种奶粉而患肾结石。三聚氰胺中N原子的杂化形式是 。
下表是Na、Mg、Si、S、Br五种元素的单质的沸点,其中b、e均是热和电的良导体。
| 单质 |
a |
b |
c |
d |
e |
| 沸点(℃) |
58.8 |
882.9 |
444.7 |
2 355 |
1 107 |
(1) a的元素在元素周期表中的位置为________。
(2) 写出d的元素原子的电子式________;其最高价氧化物形成的晶体为________晶体(填类型),溶于强碱的离子方程式为________________________________________。
(3) c与氢形成的分子X的空间构型为________;写出X的水溶液与足量b元素的最高价氧化物对应水化物反应的离子方程式___________________________________。
(4) 上述元素所能形成的简单离子中半径最小的是________(填离子符号),最高价氧化物对应水化物酸性最强的是________(填分子式),e元素与N元素形成化合物的电子式为____________________________。
(5) b元素与氯元素形成的化合物Y的晶体中,1个晶胞内含有的基本微粒及个数是________。
已知:A、B、C、D四种短周期元素,其化合价最高正价数依次为1、4、5、7,已知B原子的核外次外层电子数为2。A、C原子的核外次外层电子数为8。D元素的最高价氧化物对应的水化物是已知含氧酸中酸性最强的酸。试回答下列有关的问题:
(1)写出C元素原子的价电子轨道表达式 ;D元素的价电子排布式 。
(2)已知B元素与氢元素形成的气态化合物在标准状况下的密度为1.161g·L-1,则在该化合物的分子中B原子的杂化方式为 。
(3)已知C、D两种元素形成的化合物通常有CD3、CD5两种。这两种化合物中一种为非极性分子,一种为极性分子,则属于极性分子的化合物的化学式是 。
(4)由B元素形成具有正四面体结构的晶体和由C元素形成具有正四面体结构的晶体相比,熔点较高的晶体是 (填写晶体的名称)。
(5)由A、D两元素形成的化合物组成的晶体中,阴、阳离子都具有或近似具有球型对称结构,它们都可以看作刚性圆球,并彼此“相切”。如下图所示为A、D形成化合物的晶胞结构图以及晶胞的剖面图: 若
若
a=5.6×10-8cm,则该晶体的密度为 g·cm-3(精确到小数点后1位)。
试题篮
()