请回答下列问题:
(1)、
、
、
四种元素中,有一种元素的电离能数据如下:
| 电离能 |
(2)则该元素是(填写元素符号)。原子的电子排布式是。
的最高价氯化物分子式是。该元素可能的性质或应用有。
A.是一种活泼的金属元素
B.其电负性大于硫
C.其单质可作为半导体材料
D.其最高价氯化物的沸点低于其溴化物的沸点
关于化合物  ,下列叙述正确的有。
,下列叙述正确的有。
A.分子间可形成氢键
B.分子中既有极性键又有非极性键
C.分子中有7个键和1个
键
D.该分子在水中的溶解度大于2-丁烯
(4)的熔点
 的熔点(填>、<或=),其原因是
的熔点(填>、<或=),其原因是
卤族元素包括等。
(1)下列曲线表示卤族元素某种性质随核电荷数的变化趋势,正确的是。

(2)利用"卤化硼法"可合成含和
两种元素的功能陶瓷,下图为其晶胞结构示意图,则每个晶胞中含有
原子的个数为,该功能陶瓷的化学式为。

(3)和
中心原子的杂化方式分别为和。第一电离能介于
、
之间的第二周期元素有种。
(4)若与
通过
原子与
原子间的配位键结合形成配合物,则该配合物中提供孤对电子的原子是。
(1)依据第2周期元素第一电离能的变化规律,参照下图元素的位置,用小黑点标出
三种元素的相对位置。

(2)可由
和
在
催化剂存在下反应直接得到:
①上述化学方程式中的5种物质所属的晶体类型有(填序号)。
a.离子晶体 b.分子晶体 c.原子晶体 d.金属晶体
②基态铜原子的核外电子排布式为。
(3)与一定量水形成
晶体
,
在一定条件下可转化为
:
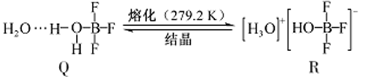
①晶体中各种微粒间的作用力不涉及(填序号)。
a.离子键 b.共价键 c.配位键 d.金属键 e.氢键 f.范德华力
②中阳离子的空间构型为,阴离子的中心原子轨道采用杂化。
(4)已知苯酚(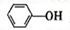 )具有弱酸性,其
)具有弱酸性,其=1.1 ×10-10;水杨酸第一级电离形成的离子
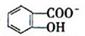 能形成分子内氢键。据此判断,相同温度下电离平衡常数
能形成分子内氢键。据此判断,相同温度下电离平衡常数(水杨酸
(苯酚)(填">"或"<"),其原因是。
元素位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素
基态原子的3p 轨道上有4个电子。元素
的原子最外层电子数是其内层的3倍。
(1)与
所形成化合物晶体的晶胞如右图所示。
①在1个晶胞中,离子的数目为。
②该化合物的化学式为。
(2)在的氢化物(
)分子中,
原子轨道的杂化类型是。
(3)的氢化物(
)在乙醇中的溶解度大于
,其原因是。
(4)与
可形成
①的空间构型为(用文字描述)。
②写出一种与互为等电子体的分子的化学式:。
(5)的氯化物与氨水反应可形成配合物
,1
该配合物中含有σ键的数目为。
元素X 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子的3p 轨道上有4个电子。元素Z 的原子最外层电子数是其内层的3倍。
(1)X与Y所形成化合物晶体的晶胞如图所示。
①在1个晶胞中,X离子的数目为 。
②该化合物的化学式为 。若其晶胞边长为540.0pm,则密度为 ,X与最近的Y之间的距离为
(2)在Y的氢化物(H2Y)分子中,Y原子轨道的杂化类型是 。
(3)Y 与Z 可形成YZ42-
①YZ42-的空间构型为 (用文字描述)。
②写出一种与YZ42-互为等电子体的分子的化学式: 。
(4)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有σ键的数目为 。
A、B、C、D、E、F、G七种元素,它们的原子序数依次增大,除G外均为前20号元素。A原子基态时p能级原子轨道上电子数等于次外能层电子数,C元素的原子基态时s能级与p能级上的电子数相等,C、D处于相同的能级,且D是同期中电负性最大的元素,E原子的第一至第四电离能(kJ·mol-1)分别为:578、1817、2745、11575,F元素原子中4s能级有2个电子。G元素的离子形成的硫酸盐结晶水合物呈蓝色。
(1)B形成的单质中σ键和Π键的个数比为 ,上述元素形成的化合物中和B的单质是等电子体的是__________(填化学式)
(2)G元素的基态原子的电子排布式为 。
(3)常温下,E单质投入到B的最高价氧化物对应的水化物的浓溶液中的现象是 。
(4)D、F组成的晶体FD2结构如图Ⅰ所示,G形成晶体的结构如Ⅲ所示,Ⅱ为H3BO3(硼酸)晶体结构图(层状结构,层内的H3BO3分子通过氢键结合)。
图Ⅰ 图Ⅱ 图Ⅲ
①图Ⅰ所示的FD2晶体中与F离子最近且等距离的F离子数为 ,图Ⅲ中未标号的G原子形成晶体后周围最紧邻的G原子数为 ;
②图Ⅱ所示的物质结构中最外能层已达8电子结构的原子是 (写元素符号),H3BO3晶体中B原子个数与极性键个数比为 ;
③三种晶体中熔点高低的顺序为 (填化学式),H3BO3晶体受热熔化时,克服的微粒之间的相互作用为 。
氮化硼(BN)是一种重要的功能陶瓷材料,以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示:
请回答下列问题:
1)由B2O3制备BF3、BN的化学方程式依次是 、 ;
2)基态B原子的电子排布式为 ;B和N相比,电负性较大的是 ,BN中B元素的化合价为 ;
3)在BF3分子中,F-B-F的键角是 ,B原子的杂化轨道类型为 ,BF3和过量NaF作用可生成NaBF4,BF4-的立体构型为 ;
4)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为 ,层间作用力为 ;
5)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm,立方氮化硼晶胞中含有 个氮原子、 个硼原子,立方氮化硼的密度是 g/cm3(只要求列算式,不必计算出数值。阿伏伽德罗常数为NA)。
下表为长式周期表的一部分,其中的编号代表对应的元素。
| ① |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |
② |
|
|
|
|
|
|
|
|
|
|
|
③ |
|
|
|
|
| |
④ |
|
|
|
|
|
|
|
|
|
|
⑤ |
|
|
⑥ |
⑦ |
|
| |
⑧ |
|
|
|
|
|
⑨ |
|
|
⑩ |
|
|
|
|
|
|
|
请回答下列问题:
(1)表中属于d区的元素是 (填编号)。
(2)表中元素①的6个原子与元素③的6个原子形成的某种环状分子名称为 ;
(3)④ ⑤ ⑥ ⑦四种元素的第一电离能由大到小的顺序是 (用元素符号表示)。
(4)按原子轨道的重叠方式,③与⑥形成的化合物中σ键有 个,π键有 个。
(5)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的孤对电子数为 ;该元素与元素①形成的分子X的空间构形为 ,属于 分子(填“极性”或“非极性”)。
(6)某些不同族元素的性质也有一定的相似性,如上表中元素⑤与元素②的氢氧化物有相似的性质。请写出元素②的氢氧化物与NaOH溶液反应的化学方程式: 。
(7)1183 K以下⑨元素形成的晶体的基本结构单元如图1所示,1183 K以上转变为图2所示结构的基本结构单元,在两种晶体中最邻近的原子间距离相同。

在1183 K以下的晶体中,与⑨原子等距离且最近的⑨原子数为______个,在1183 K以上的晶体中,与⑨原子等距离且最近的⑨原子数为________。
有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比
B-少一个电子层,B原子得一个电子后3p轨道全满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为序40%,且其核内质子数等于中子数。R是由A、D两元素形成的离子化合物,其中A与D离子的数目之比为2∶1。请回答下列问题。
(1)A单质、B单质、化合物R的熔点大小顺为下列的________(填序号)。
①A单质>B单质>R ②R>A单质>B单质
③B单质>R>A单质 ④A单质>R>B单质
(2)CB3分子的空间构型是________,其固体时的晶体类型为______________。
(3)写出D原子的核外电子排布式:________________________,C的氢化物比D的氢化物在水中的溶解度大得多的原因是__________________________________________。
(4)B元素和D元素的电负性大小关系为____________。
(5)A与B形成的离子化合物的晶胞中,每个A+周围与它距离相等且最近的B-有______个,这些B-围成的空间几何构型为____________。
A、B、C是中学化学中常见的三种短周期元素。已知:①A元素原子最外层电子数是次外层电子数的2倍;②B元素最高正价与最低负价的代数和为2;③C元素有多种化合价,且常温下C元素的单质与某种一元强碱溶液反应,可得到两种含C元素的化合物;④B、C两种元素质子数之和是A元素质子数的4倍。
(1)写出常温下C的单质和强碱溶液反应的离子方程式____________________。
(2)意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的B4气态分子。B4分子结构与白磷分子结构相似 ,已知断裂1 mol B—B键吸收167 kJ的热量,生成1 mol B≡B键放出942 kJ热量。试判断相同条件下B4与B2的稳定性顺序是:______________。
,已知断裂1 mol B—B键吸收167 kJ的热量,生成1 mol B≡B键放出942 kJ热量。试判断相同条件下B4与B2的稳定性顺序是:______________。
 (3)由B、C两种元素组成的化合物X,常温下为易挥发的淡黄色液体,X分子为三角锥形分子,且分子里B、C两种原子最外层均达到8个电子的稳定结构。X遇水蒸气可形成一种常见的漂白性物质。则X与水反应的化学方程式是____________________________。
(3)由B、C两种元素组成的化合物X,常温下为易挥发的淡黄色液体,X分子为三角锥形分子,且分子里B、C两种原子最外层均达到8个电子的稳定结构。X遇水蒸气可形成一种常见的漂白性物质。则X与水反应的化学方程式是____________________________。
(4)A、B两种元素可形成一种硬度比金刚石还大的化合物Y。在化合物Y中,A、B原子间以单键相结合,且每个原子的最外层均达到8个电子的稳定结构。则Y的化学式为
______________,其熔沸点比金刚石_____(填“高”、“低“或“无法比较”)。
试题篮
()