(12分)〔物质结构与性质〕
我国部分城市灰霾天占全年一半,引起灰霾的PM2.5微细粒子包含(NH4)2SO4、NH4NO3,有机颗粒物及扬尘等。通过测定灰霾中锌等重金属的含量,可知目前造成我国灰霾天气主要是交通污染。
(1)Zn2+在基态时核外电子排布式为
(2)SO42-的空间构型是 (用文字描述)。
(3)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾污染,光化学烟雾中含有NOX、O3,CH2=CH-CHO,HCOOH,CH3COOONO2(PAN)等二次污染物。
①下列说法正确的是 (不定项选择)。
a.N2O结构式可表示为N=N=O
b.O3分子呈直线形
c.CH2=CH-CHO分子中碳原子均采用sp2杂化
d.相同压强下,HCOOH沸点比CH3OCH3高,说明前者是极性分子,后者是非极性分子
②1mo1PAN中含σ键数目为 。
③NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]S04,该配合物中心离子的配位数为 (填数字).
(4)测定大气中PM2.5的浓度方法之一是β一射线吸收法,β一射线放射源可用85Kr,已知Kr晶体的晶胞结构如图所示,设晶体中与每个Kr原子相紧邻的Kr原子有m个,晶胞中含Kr原子为n个,则m/n= (填数字)。
【化学—选修3物质结构与性质】(14分)
现有X、Y、Z、W原子序数依次增大的四种元素,常温下X元素单质的密度在自然界中最小,Y是短周期元素中未成对电子数与原子序数之比最大的原子,Z元素基态原子的核外电子排布式中,s亚层电子总数与p亚层电子总数相等,且Y与Z可形成多种气态化合物,W是常见的有色可变价金属单质,常温下可溶于Y的最高价氧化物水化物中,其基态原子的内层轨道全部排满电子,且最外层电子数为1。
(1)Y与W所形成化合物晶体的晶胞如图所示。在1个晶胞中,W离子的数目为 。
(2)在Y与X形成的分子中,Y原子轨道的杂化类型是 。
(3)X与Y形成的气态物质在X与Z形成的气态物质中有很大的溶解度,其原因是存在氢键,若在两种氢化物的混合溶液中,再滴加少量的乙醇,则分子间存在 种不同类型的氢键。
(4)Y与Z可形成化合物Y2Z。
①请写出一种与Y2Z互为等电子体的分子的化学式 。
②请预测Y2Z分子的空间构型为 。
(5)Y与Z元素相比,基态原子的第一电离能谁大? (用元素名称回答)。
(6)X的氯化物与Y元素的气态氢化物的水溶液反应可形成配合物[W(YX3)4]Cl2,1 mol该配合物中含有σ键的数目为 个。
【化学—物质结构与性质】
CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等。已知:
①CuCl可以由CuCl2用适当的还原剂如SO2、SnCl2等还原制得:
2Cu2++2Cl-+SO2+2H2O=2CuCl↓+4H++SO42-
2CuCl+SnCl2=2CuCl↓+SnCl4
②CuCl2溶液与乙二胺(H2N—CH2—CH2—NH2)可形成配离子[Cu(En)2]2+(En是乙二胺的简写):
请回答下列问题:
(1)配离子[Cu(En)2]2+的中心原子基态外围电子排布式为 ,H、N、O三种元素的电负性由大到小的顺序是 ;
(2)SO2分子的空间构型为 ;
(3)乙二胺分子中氮原子轨道的杂化类型为 ,乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是 。
(4)配离子[Cu(En)2]2+的配位数为 ,该微粒含有的微粒间的作用力类型有 (填字母);
| A.配位键 |
| B.极性键 |
| C.离子键 |
| D.非极性键 |
E.氢键
F.金属键
(5)CuCl的晶胞结构如图所示,
其中Cl-的配位数(即与Cl- 最近距离的Cu+的个数)为 。
(18 分)A、B、C、D、E、F 是周期表中的前20 号元素,原子序数逐渐增大。A 元素是宇宙中含量最丰富的元素,原子的原子核内可能没有中子。B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相等;C 元素原子最外层p 能级比s 能级多1 个电子;D 原子p 轨道上成对电子数等于未成对电子数;E 的常见化合价为+3;F 最高正价与最低负价的代数和为4; G+的M 层电子全充满。用化学式或化学符号回答下列问题:
(1)G 的基态原子的外围电子排布式为 ,周期表中F 属于 区。
(2)B 与F 形成的一种非极性分子的电子式为 ;F 的一 种 具有较强还原性的氧化物分子的VSEPR 模型为
(3)BD2在高温高压下所形成的晶胞如图所示。
该晶体的类型属于_______(选填“分子”、“原子”、“离子”或“金属”)晶体
(4)设C 元素的气态氢化物为甲,最高价氧化物的水化物为乙,甲与乙反应的产物为丙。常温下,有以下3 种溶液:①pH=11 的甲的水溶液 ②pH=3 的乙的水溶液 ③pH=3的丙溶液,3种溶液中水电离出的c(H+)之比为 。
(5)丁、戊分别是E、F 两种元素最高价含氧酸的钠盐,丁、戊溶液能发生反应。当丁、戊溶液以物质的量之比为1:4 混合后,溶液中各离子浓度大小顺序为 。
(6)A 和C 形成的某种氯化物CA2Cl 可作杀菌剂,其原理为CA2Cl 遇水反应生成一种具有强氧化性的含氧酸,写出CA2Cl 与水反应的化学方程式:___________________________
(7)往G 的硫酸盐溶液中加入过量氨水,可生成一种配合物X,下列说法正确的是
A.X中所含化学键有离子键、极性键和配位键
B.X中G2+给出孤对电子,NH3提供空轨道
C.组成X 的元素中第一电离能最大的是氧元素
D.SO42-与PO43-互为等电子体,空间构型均为正四面体
【化学——选修3:物质结构与性质】
氢能的存储是氢能应用的主要瓶颈,配位氢化物、富氢载体化合物是目前所采用的主要储氢材料。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。在基态Ti2+中,电子占据的最高能层符号为_____________,该能层具有的原子轨道数为____________________。
(2)液氨是富氢物质,是氢能的理想载体,利用N2+3H2  2NH3,实现储氢和输氢。下列说法正确的是________________。
2NH3,实现储氢和输氢。下列说法正确的是________________。
| A.NH3分子中氮原子的轨道杂化方式为sp2杂化 |
| B.NH4+与PH4+、CH4、BH4-、ClO4-互为等电子体 |
| C.相同压强时,NH3的沸点比PH3的沸点高 |
| D.[Cu(NH3)4]2+中,N原子是配位原子 |
(3)已知NF3与NH3的空间构型相同,但NF3不易与Cu2+形成配离子,其原因是__________________。
(4)用价层电子对互斥理论推断SnBr2分子中,Sn原子的轨道杂化方式为 ,SnBr2分子中Sn—Br的键角 120°(填“>”“<”或“=”)。
(5)NiO的晶体结构与氯化钠相同,在晶胞中镍离子的配位数是_______。已知晶胞的边长为a nm,NiO的摩尔质量为b g·mol-1,NA为阿伏加德罗常数的值,则NiO晶体的密度为_________g·cm-3。
【化学—--选修3:物质结构与性质】
| 元素 |
A |
B |
C |
D |
| 性质 结构 信息 |
原子核外有两个电子层,最外层有3个未成对的电子 |
原子的M层有1对成对的p电子 |
原子核外电子排布为[Ar]3d104sx,有+1、+2两种常见化合价 |
有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |
四种常见元素的性质或结构信息如下表。试根据信息回答有关问题。
(1)A元素与其同周期相邻两种元素原子的第一电离能由大到下的顺序为 (用元素符号表示);
(2)B元素的低价氧化物分子中心原子的杂化方式为 ,B元素与D元素形成分子空间构型为 ;
(3)D元素最高价氧化物的熔点比同主族相邻元素最高价氧化物的熔点 (填“高”或“低”),其原因是______________________________________;
(4)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,观察到的现象为________________;
(5)C晶体的堆积方式如图所示,
设C原子半径为r,晶胞中C原子的配位数为_______,晶胞的空间利用率为 。
[化学——选修3:物质结构与性质](15分)硅是重要的半导体材料,构成了现代电子工业的基础。回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号为______,该能层具有的原子轨道数为_____、电子数为____。
(2)硅主要以硅酸盐、______等化合物的形式存在于地壳中。
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以______相结合,其晶胞中共有8个原子,其中在面心位置贡献______个原子。
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备。工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为______________________。
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
| 化学键 |
C—C |
C—H |
C一O |
Si—Si |
Si—H |
Si一O |
| 键能/(kJ·mol-1) |
356 |
413 |
336 |
226 |
318 |
452 |
①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是_____________。
②SiH4的稳定性小于CH4,更易生成氧化物,原因是__________________________。
(6)在硅酸盐中,SiO44-四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为__________。Si与O的原子数之比为__________________。
【化学—物质结构与性质】
科技日报报道:辉钼(MoS2)在纳米电子设备制造领域比硅或富勒烯(如C60)更有优势。从不同角度观察MoS2的晶体结构见图。已知:Mo位于第五周期VIB族。
(1)晶体硅中硅原子的轨道杂化类型为______。
(2)电负性:C______S(填“>”或“<”)。
(3)晶体硅和C60比较,熔点较高的是______。
(4)Mo元素基态原子的价电子排布式为____________。
(5)根据MoS2的晶体结构回答:
①每个Mo原子周围距离最近的S原子数目为______。
②Mo-S之间的化学键为______(填序号)。
A极性键 B非极性键 C配位键 D金属键 E范德华力
③MoS2纳米粒子具有优异的润滑性能,其原因是______。
A、B、C、D分别代表四种不同的短周期元素。A元素的原子最外层电子排布为ns1,B元素的原子价电子排布为ns2np2,C元素的最外层电子数是其电子层数的3倍,D元素原子的M电子层的P亚层中有4个电子。
(1)D原子的电子排布式为 ,若A元素的原子最外层电子排布为1s1,则按原子轨道的重叠方式,A与C形成的化合物中的共价键属于 键。
(2)当n=2时,B的原子结构示意图为 ,B与C形成的晶体属于 晶体。
当n=3时,B与C形成的晶体属于 晶体。
(3)若A元素的原子最外层电子排布为2s1,B元素的原子价电子排布为3s23p2,元素A在周期表中的位置是 ,A、B、C、D四种元素的电负性由大到小的顺序是 (用元素符号表示)。
(4)C和D的最简单氢化物相比较:稳定性: (填化学式,下同);
沸点: 原因是 。
柠檬酸铁可用作食品铁质强化剂、营养增补剂,用于饼干、钙质奶粉等,它可以由柠檬酸(熔点为153ºC)与氢氧化铁制得。其结构如图。

(1)柠檬酸的晶体类型为 。
(2)柠檬酸铁中基态Fe3+的价电子排布式为 。
(3)柠檬酸铁所含非金属元素,电负性从小到大的顺序为 (填元素符号)。
(4)柠檬酸铁中,碳原子的杂化轨道类型为 。
(5)I2(Fe) I3(Fe)(填“>”或“<”)。
(6)柠檬酸铁溶液中不存在的微粒间作用力为 (填序号)。
A.离子键 B.极性键 C.非极性键
D.金属键 E.氢键 F.范德华力
(7)H3O+中H-O-H键角比H2O中H-O-H键角大,原因是 。
已知A、B、C、D都是短周期元素,它们的原子半径大小为B>C>D>A。B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子有2个未成对电子。A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体。E是第四周期元素,其原子核外最外层电子数与A原子相同,其余各层电子均充满。回答下列问题(用元素符号或化学式表示)。
(1)M分子中B原子轨道的杂化类型为 。
(2)化合物CA3的沸点比化合物BA4的高,其主要原因是 。
(3)写出与BD2互为等电子体的C3-的结构式 。
(4)E+的核外电子排布式为 ,下图是D、E形成的某种化合物的晶胞结构示意图,该晶体1个晶胞中阳离子的个数为 。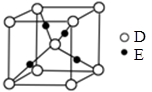
(5)向E的硫酸盐溶液中通入过量的CA3,可生成[E(CA3)4]2+配离子,1 mol [E(CA3)4]2+中含有σ键的数目为 。
【化学—选修3:物质结构与性质】
CuSO4在活化闪锌矿(主要成分是ZnS)方面有重要作用,主要是活化过程中生成CuS、Cu2S等一系列铜的硫化物活化组分。
(1)Cu2+基态的电子排布式可表示为 ;
(2)SO42-的空间构型为 (用文字描述);中心原子采用的轨道杂化方式是 ;写出一种与SO42-互为等电子体的分子的化学式: ;
(3) 向CuSO4溶液中加入过量NaOH溶液可生成[Cu (OH)4 ]2-。不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为 ;
(4)资料显示ZnS为难溶物,在活化过程中,CuSO4能转化为CuS的原因是 。
(5)CuS比CuO的熔点 (填高或低),原因是 。
(6)闪锌矿的主要成分ZnS,晶体结构如下图所示,其晶胞边长为540.0 pm,密度为____________(列式并计算),a位置S2-离子与b位置Zn2+离子之间的距离为___________________pm(列式表示)。
已知:硫酸铜溶液中滴入氨基乙酸钠(H2N-CH2-COONa)即可得到配合物A。其结构如下图:
(1)Cu元素基态原子的外围电子排布式为 。
(2)元素C、N、O的第一电离能由大到小排列顺序为 。
(3)配合物A中碳原子的轨道杂化类型为 。
(4)1mol氨基乙酸钠(H2N-CH2-COONa)含有 键的数目为 。
键的数目为 。
(5)氨基乙酸钠分解产物之一为二氧化碳。写出二氧化碳的一种等电子体: (写化学式)。
(6)已知:硫酸铜灼烧可以生成一种红色晶体,其结构如图,
则该化合物的化学式是 。
[化学——物质结构与性质]
物质结构理论有助于人们研究化学反应规律。请回答下列问题:
(1)在第三周期中,第一电离能大于硫的元素有 种;
(2)铜及其化合物在科学研究和工农业生产中有许多用途。
①铜原子价电子排布式为
②氯、钾、铜(+1价)三元素可形成一种化合物,该化合物阴离子为无限长链结构(如图甲),a位置上Cl原子的杂化轨道类型为 。该化合物阴离子的化学式为 ;
③向CuSO4溶液中加入过量氨水,可生成[Cu(NH3)4]SO4,下列说法正确的是 。
| A.氨气极易溶液水,是因为NH3分子和H2O分子之间形成3种不同的氢键 |
| B.NH3分子的键角小于H2O分子的键角 |
| C.[Cu(NH3)4]SO4所含的化学键有离子键、极性共价键和配位键 |
| D.[Cu(NH3)4]SO4组成元素中电负性最大的是氮元素 |
④葡萄糖与新制氢氧化铜的碱性溶液反应生成砖红色沉淀A,其晶胞如右图乙所示。A的化学式为 ,晶胞中的白点代表的原子是 (填元素名称)。
X、Y、Z、W是元素周期表前四周期中常见的元素,其相关信息如下表:
| 元素 |
相 关 信 息 |
| X |
X的基态原子L层电子数是K层电子数的2倍 |
| Y |
Y的基态原子最外层电子排布式为:nsnnpn+2 |
| Z |
Z的一种核素的中子数为12,质量数为23 |
| W |
W有多种化合价,其白色氢氧化合物在空气中会迅速变成灰绿色,最后变成红褐色 |
(1)W位于元素周期表第____周期第____族,
基态W2+的核外电子排布式为 。
(2)X的电负性比Y的____________(填“大”或“小”);X 和Y形成的XY32-离子中,中心原子的杂化类型是___________,其离子的空间构型为为 。
(3)写出Z2Y2的电子式 ,指出其中含有的化学键 ;XY2形成的晶体类型为 。
试题篮
()