VA族的氮、磷、砷(As)等元素在化合物中常表现出多种氧化态,含VA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题:
(1)白磷单质的中P原子采用的轨道杂化方式是 ;
(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,N、P、As原子的第一电离能由大到小的顺序为 ;
(3)As原子序数为 ,其核外M层和N层电子的排布式为 ;
(4)NH3的沸点比PH3 (填“高”或“低”),原因是 .PO43-离子的立体构型为 ;
(5)H3PO4的K1、K2、K3分别为7.6×10-3、6.3×10-8、4.4×10-13.硝酸完全电离,而亚硝酸K=5.1×10-4,请根据结构与性质的关系解释:
①H3PO4的K1远大于K2的原因 ;
②硝酸比亚硝酸酸性强的原因 ;
(6)NiO晶体结构与NaCl晶体类似,其晶胞的棱长为a cm,则该晶体中距离最近的两个阳离子核间的距离为 cm(用含有a的代数式表示).在一定温度下NiO晶体可以自发地分散并形成“单分子层”(如图),可以认为氧离子作密致单层排列,镍离子填充其中,列式并计算每平方米面积上分散的该晶体的质量为 g (氧离子的半径为1.40×10-10m) 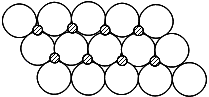
卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。
(1)基态溴原子的价电子排布式为 。
(2)卤素互化物如IBr、ICl等与卤素单质结构相似、性质相近。则Cl2、IBr、ICl的沸点由高到低的顺序为 。
(3)气态氟化氢中存在二聚分子(HF)2,这是由于 。
(4)互为等电子体的微粒相互之间结构相似。I3+属于多卤素阳离子,根据VSEPR模型推测I3+的空间构型为 ,中心原子杂化类型为 。
(5)①HClO4、②HIO4、③H5IO6[可写成(HO)5IO]的酸性由强到弱的顺序为 (填序号)。
(6)卤化物RbICl2在加热时会分解为晶格能相对较大的卤化物A和卤素互化物或卤素单质,A的化学式 。
(7)如图所示为卤化物冰晶石(化学式为Na3AlF6)的晶胞。图中●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,▽是图中●、○中的一种。图中●、○分别指代哪种粒子 、 ;大立方体的体心处▽所代表的是 。
氮、磷、锌是与生命活动密不可分的元素。请回答下列问题:
(1)NH3和pH3都是极性分子,其中极性较大的是______,理由是______。
(2)NH4NO3是一种重要的化学肥料,其中N原子的杂化方式是______。
(3)氮化硼(BN)的一种晶体结构与金刚石相似,则B-N-B之间的夹角是____________。氮化砸的密度为3.52g/cm3,则B-N键的键长是______pm (只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。
(4)已知磷酸分子中,P、O原子均满足最外层8个电子的稳定结构,则:
①P与非羟基O之间的共价键的形成方式是____________;
②中和20mL0.1mol/L次磷酸(H3PO2)溶液需要0.1mo/L NaOH溶液的体积恰好为20 mL,则H3PO2的结构式是____________。
(5)Zn2+基态时的电子排布式是______,ZnO和ZnS的晶体结构相似,其中熔点较高的是______,理由是________________________
(1)CH3+ 、-CH3(甲基)、CH3-都是重要的有机反应中间体,有关它们的说法正确的是
| A.它们均由甲烷去掉一个氢原子所得 |
| B.它们互为等电子体,碳原子均采取sp2杂化 |
| C.CH3-与NH3、H2O+互为等电子体,几何构型均为三角锥形 |
| D.CH3+中的碳原子采取sp2杂化,所有原子均共面 |
E.两个-CH3(甲基)或一个CH3+和一个CH3-结合均可得到CH3CH3
(2)锌是一种重要的金属,锌及其化合物有着广泛的应用。
①锌在元素周期表中的位置是:_ 。
②葡萄糖酸锌[CH2OH(CHOH)4COO]2Zn是目前市场上流行的补锌剂。写出Zn2+基态电子排布式 ,葡萄糖分子[CH2OH(CHOH)4CHO]中碳原子杂化方式有 。
③Zn2+能与NH3形成配离子[Zn(NH3)4]2+。配位体NH3分子属于 (填“极性分子”或“非极性分子”);在〔Zn(NH3)4]2+中,Zn2+位于正四面体中心,N位于正四面体的顶点,试在左下图中表示出[Zn(NH3)4]2+中Zn2+与N之间的化学键。
④右上图示锌与某非金属元素X形成的化合物晶胞,其中Zn和X通过共价键结合,该化合物的Zn与X的原子个数之比为 。
⑤在④的晶胞(右上图)中,如果只考查X的排列方式,则X的堆积方式属于金属晶体堆积方式中的___ 堆积;设该晶胞中Zn的半径为r1 cm,其相对原子质量为M1,X的半径为r2cm,其相对原子质量为M2,则该晶体的密度为_ g/cm3 (写出含有字母的表达式)。
卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。
(1)卤素互化物如IBr ICl等与卤素单质结构相似、性质相近。Cl2、IBr、ICl沸点由髙到低的顺序为
_____,I和Cl相比,电负性较大的是_____。
(2)基态溴原子的电子排布式为_____,碘原子价电子的电子排布图为_____。
(3)I3+属于多卤素阳离子,根据VSEPR模型推测I3+的空间构型为______,中心I原子的杂化轨道类型为
__________。
(4)请推测①HClO4、②HIO4、③H5IO6[可写成(HO)5IO]三种物质的酸性由强到弱的顺序为_______(填序号)。
(5) 离子化合物RbICl2存在复合阴离子,且晶体结构与NaCl相似,晶胞边长为685.5pm( pm=10-12m), RbICl2晶胞中含有______个氯原子,RbICl2晶体的密度是_____g•cm3(只要求列箅式,不必计算出数值。阿伏伽德罗常数为NA)。
已知A、B、C、D均是元素周期表中前36号中的元素,其原于序数依次递增,其他相关结构或性质信息如下表。
| 元素 |
结构或性质信息 |
| A |
原子核外有一个未成对电子,其氢化物与水分子间能形成氢键 |
| B |
原子核外M层电子数是N层电子数的4倍 |
| C |
是使用最为广泛的合金的主要成分 |
| D |
原子各内层电子均已饱和,最外层电子数为1 |
请根据信息回答有关问题:
(1)C元素在周期表中的位置为____ ,D元素原子的外围电子排布式为
(2)用氢键表示式写出A的氢化物水溶液中存在的所有氢键____ 。
(3)A与氧可形成原子个数比为2:1的三原子分子,其中氧的化合价为____ ,氧原子杂化类型与下列分子的中心原子杂化类型相同的是____
a:CO2 b:SO2 c:NH3 d;CH4
(4)A、B可形成离子化合物,其晶胞结构如下图甲所示,则晶胞中B离子的个数为____ ,与B离子最近且等距的A离子的个数为 。
(5)1183 K以下C晶体的晶胞如图乙中图1,而1183 K以上则转变为图2,在两种晶胞中最邻近的C原子间距离相同,则图1、图2所示两种晶中原子的空间利用率之比为___ _(可用根号表示)。
现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期,B元素原子的价层电子总数是内层电子总数的2倍;D元素原子的L电子层中只有两对成对电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子。请回答下列问题:
(1) E元素基态原子的核外价层电子排布式为_________。
(2)用元素符号表示B、C、D三种元素的第一电离能由低到高的排序_________。
(3) A元素与B、C元素可形成化合物B2A4、C2A4。
①B2A4的结构式为_________。
②下列有关C2A4的说法正确的是_________。
a.一个该分子中含有4个σ键
b.该分子可作为配位体形成配位键
c.该分子是非极性分子 d.1mol该分子最多可形成4mol氢键
e.该分子的稳定性与氢键无关
f.该分子中C的原子轨道是sp3杂化
(4)B单质的一种的晶体结构如图甲所示,E单质的一种的晶体结构如图乙所示。
则图中的单质B的名称_________,图甲中B原子的配位数与图乙中E原子的配位数之_________。
E元素与D元素形成的ED晶体与NaCl晶体一样,欲比较ED与NaCl的晶格能大小,需考虑的数据是_______________________________________________________________________________。
(5)据最新资料显示,F单质的晶胞可能有多种,若其晶胞分别以六方紧密堆积和面心立方堆积存在时,其单质的密度之比为_________。
铁及铁的化合物在生产、生活中有着重要的用途。
(1) 已知铁是26号元素,写出Fe的价层电子电子排布式________。已知自然界丰度最大的铁的同位素是中子数为30的铁原子,则该种同位素符号________。
(2) Fe原子或离子外围有较多能量相近的空轨道,因此能与一些分子或离子形成配合物,则与之形成配合物的分子的配位原子应具备的结构特征是________。Fe(CO)3一种配合物,可代替四乙基铅作为汽油的抗爆震剂,其配体是CO分子。写出CO的一种常见等电子体分子的结构式________;两者相比较,沸点较髙的是________填分子式)。
(3) 1183K以下纯铁晶体的晶胞如图1所示,1183K以上则转变为图2所示晶胞,在两种晶体中最邻近的铁原子间距离相同。
①图1和图2中,铁原子的配位数之比为________。
②空间利用率是指构成晶体的原子、离子或分子在整个晶体空间中占有的体积百分比,则图1和图2中,铁原子的空间利用率之比为________。
有A、B、C、D、E、F六种元素,A是周期表中原子半径最小的元素,B是电负性最大的元素,C的2p轨道中有三个未成对电子,F原子核外电子数是B 与C核外电子数之和,D 是主族元素且与E同周期,E能形成红色或砖红色E2O和黑色的EO两种氧化物,D与B可形成离子化合物,其晶胞结构如图所示。请回答下列问题:
(1)E+离子基态时的电子排布式为_______________
(2)A2F的分子空间构型为_____________,FO3分子中F原子的杂化方式 ______________
(3)CA3极易溶于水,其原因主要是______________
(4)从图中可以看出,D 与B形成的离子化合物的化
学式为______________(用元素符号表示),该离子晶体的
密度为ag·cm-3,则晶胞的体积是____________(写出表达式即可,不用化简)
(5)已知E单质的晶体为面心立方最密堆积 (在晶胞的顶点和面心均含有一个E原子),则 E的晶体中E原子的配位数为
决定物质性质的重要因素是物质的结构。请回答下列问题:
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
| 电离能/kJ·mol-1 |
I1 |
I2 |
I3 |
I4 |
| A |
578 |
1817 |
2745 |
11578 |
| B |
738 |
1451 |
7733 |
10540 |
A通常显 价,A的电负性 B的电负性(填“>”、“<”或“=”)。
(2)已知:波长为300 nm的紫外光的光子,光子的能量与光的频率的关系为E=hv,式中h=6.63×10-34J·s,光的波长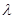 与光的频率v的关系为
与光的频率v的关系为 ,其中光速c=3×108m·s-1。根据下表有关蛋白质分子中重要化学键的信息,求波长为300 nm的紫外光的光子所具有的能量 kJ·mol-1,说明人体长时间照射紫外光后皮肤是否会受伤害的原因: 。(未说明原因不给分)
,其中光速c=3×108m·s-1。根据下表有关蛋白质分子中重要化学键的信息,求波长为300 nm的紫外光的光子所具有的能量 kJ·mol-1,说明人体长时间照射紫外光后皮肤是否会受伤害的原因: 。(未说明原因不给分)
| 共价键 |
C—C |
C—N |
C—S |
| 键能/kJ·mol-1 |
347 |
305 |
259 |
(3)科学家通过X射线探明,KCl、MgO、CaO、TiN的晶体结构与NaCl的晶体结构相似。下表是3种离子晶体的晶格能数据:
| 离子晶体 |
NaCl |
KCl |
CaO |
| 晶格能/kJ·mol-1 |
786 |
715 |
3401 |
离子键的强弱可以用离子晶体的晶格能来衡量,KCl、CaO、TiN 3种离子晶体熔点从高到低的顺序是 。MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有 个。
(4)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是 。
(5)某配合物的分子结构如图所示,其分子内不含有 (填字母)。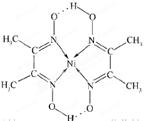
A.离子键 B.共价键 C.配位键 D.氢键
A、B、C都是元素周期表中的短周期非金属元素,它们的核电荷数依次增大。A原子的核外成对电子数与未成对电子数相等,B原子的最外层p轨道的电子为半满结构,C是地壳中含量最多的元素。D、E是第四周期元素,D原子核外最外层电子数有1个电子,其余各层电子均充满;E原子核外未成对电子数在同周期中最多。请用对应的元素符号或化学式填空: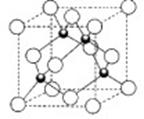
⑴A、B、C的第一电离能由小到大的顺序为 。
⑵D与E的原子化热分别为340 kJ·mol-1和125 kJ·mol-1,则它们的熔点:D E(填“>”、“<”、“="”" )。
⑶分子A2B2中键与键之间的夹角为180°,并有对称性,每个原子最外层电子数均满足八电子,其结构式为_____________,1mol该分子中含有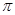 键的数目为 。
键的数目为 。
⑷基态E原子的外围电子排布式为 。EO2Cl2熔点:-96 .5℃,沸点:117℃,则固态EO2Cl2属于 晶体。
⑸D的氢化物的晶体结构如图所示,其化学式是 ,图中白球构成的晶体结构是由 (填“密置层”或“非置密层”)按一定的方式在三维空间堆积形成的,写出此氢化物在氯气中燃烧的化学方程式 。
(1)写出CO2+离子基态的价电子排布式:__________________________________。
(2)SO32-的空间构型是:___________________________________________。
(3)OCN-与CO2是等电子体,则OCN-中C原子的杂化方式是:_______________。
(4)六方氮化硼(BN)晶体具有很高的熔点,B原子和N原子均为sp2杂化。该晶体中存在的作用力有:__________________。
(5)元素O、Mg、Ni可形成一种晶体,其晶胞如图所示。在晶体中,每个Ni2+离子与_____________个Mg2+离子配位。该晶体的化学式是____________。
MnO2是碱锰电池材料中最普通的正极材料之一,在活性材料MnO2中加入CoTiO3纳米粉体,可以提高其利用率,优化碱锰电池的性能。
(1)写出基态Mn原子的核外电子排布式 。
(2)CoTiO3晶体结构模型如图1所示。在CoTiO3晶体中1个Ti原子、1个Co原子,周围距离最近的O原子数目分别为 个、 个。
(3)二氧化钛(TiO2)是常用的、具有较高催化活性和稳定性的光催化剂, 常用于污水处理。O2在其催化作用下,可将CN-氧化成CNO-,进而得到N2。与CNO- 互为等电子体的分子、离子化学式分别为 、 (各写一种)。
(4)三聚氰胺是一种含氮化合物,其结构简式如图所示。 
三聚氰胺分子中氮原子轨道杂化类型是 , 1 mol三聚氰胺分子中 σ键的数目为 。
硼.碳.氮.硅元素的单质及其化合物是构成自然界的重要物质。
(1)硼元素原子核外电子排布式_________________。氮元素原子的核外电子中,未成对电子数与成对电子数之比为 。
(2)甲烷是最简单的有机物,实验室可通讨下列反应制取: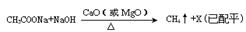 ,反应涉及到的物质中,X属于 晶体(填 晶体类型),MgO晶体的熔点比CaO高,主要原因是 。
,反应涉及到的物质中,X属于 晶体(填 晶体类型),MgO晶体的熔点比CaO高,主要原因是 。
(3)甲硅烷能与硝酸银发生如下反应:SiH4+8AgNO3+2 H2O → 8Ag↓+SiO2↓+8 HNO3该反应中氢元素被氧化,由此可判断非金属性Si比 H (填“强”.“弱”或“无法比较”)
(4)石墨晶体具有层状结构,在层与层之间嵌入金属K原子,能形成石墨夹层离子化合物(KC8),KC8固态时也能导电,导电的粒子是 。
I.下列说法中正确的是 。
| A.第一电离能由大到小的顺序为O>N>C |
B.由于C 和O 和O 互为等电子体,所以可以推断O 互为等电子体,所以可以推断O 的电子式为 的电子式为 |
| C.根据岩浆晶出规则,Ca0比Mg0更容易在岩浆冷却过程中先结晶 |
| D.液态HF通常也可以写成(HF)n的形式,是因为液态HF分子间存在氢键 |
Ⅱ.(1)兰聚氰胺分子的结构简式如图所示,则其中氮原子轨道杂化类型是 ,l mol三聚氰胺分子中含 mol 键。
键。 
(2)某元素位于第四周期VIII族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,则其基态原子的M层电子排布式为____ 。
(3)过渡金属配合物Ni( CO)n的中心原子价电子数与配体提供电子总数之和为18,则n=____ 。
(4)碳化硅的晶胞结构(如右图)与金刚石类似(其中“●”为碳原子,“○”为硅原子)。图中“●”点构成的堆积方式与下列图式中 所表示的堆积方式相同。

(5)碳化硅的结构中,与碳原子距离最近且相等的碳原子有 个。设晶胞边长为a cm,碳原子直径为b cm,硅原子直径为c cm,则该晶胞的空间利用率为 (用含a、b、c的式子表示)。
试题篮
()