请回答下列问题:
(1)下列现象和应用与电子跃迁无关的是________________________________。
A.激光 B.焰色反应 C.原子光谱 D.燃烧放热 E.石墨导电
(2)A、B两种短周期元素,A是原子半径最小的元素,B原子最外层电子数是次外层的两倍。某平面正六边形分子由A、B两种元素组成且原子个数比为1:1,该分子中含有_______个σ键。
(3)元素铬化合物(CrO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。
①与铬同周期的基态原子中最外层电子数与铬原子相同的元素有___________(填元素符号)
②在a:苯 b:CH3OH c:HCHO d:CS2 e:CCl4 五种有机溶剂中,碳原子采取sp3杂化的分子有___________(填字母),CS2分子的键角是__________。
③过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般地,为d0或d10排布时,无颜色;为d1~d9排布时,有颜色,如[Co(H2O) 6]2+显粉红色。据此判断,[Mn(H2O) 6]]2+ _____________(填“无”或“有”)颜色
(4) 请写出HClO的电子式:_______________________;在下图配合物离子[Cu(NH3)4]2+.中的画出配位键:
(5) A、B均为短周期金属元素。依据下表数据和已学知识,
| 电离能/KJ·mol-1 |
I1 |
I2 |
I3 |
I4 |
| A |
932 |
1821 |
15390 |
21771 |
| B |
738 |
1451 |
7733 |
10540 |
判断金属B的价电子电子排布式______,写出金属B与二氧化碳反应的化学方程式: _______________________________________________。
A、B、C、D、E、F为原子序数依次增大的短周期元素,B、C相邻且同周期,A、D同主族。A、C能形成两种化合物甲和乙,原子个数比分别为2∶1和1∶1,甲为常见的溶剂。E是地壳中含量最多的金属元素。F元素为同周期电负性最大的元素。D和F可形成化合物丙,E和F可形成化合物丁。G为第四周期未成对电子数最多的元素
请回答下列问题:
(1)写出G基态原子的外围电子排布式 。
(2)B和C比较,第一电离能较大的元素是 (填元素符号),其原因为 。
(3)甲、乙两分子中含有非极性共价键的是 (填分子式)。
(4)已知化合物丁熔点190℃,沸点183℃,结构如图所示。
①丙和丁比较,熔点较低的化合物是 (填化学式),其原因为 。
②则丁晶体中含有的作用力有 (填序号)。
A.离子键 B.共价键 C.金属键 D.配位键 E.范德华力
(5)G3+与元素A、C、F构成配合物戊,在含有0.001mol戊的溶液中加入过量AgNO3溶液,经过滤、洗涤、干燥后,得到287mg白色沉淀。已知该配合物的配位数为6,则戊的化学式为 。
(6)三聚氰胺(结构如图)由于其含氮量高被不法奶农添加到牛奶中来“提高”蛋白质的含量,造成全国许多婴幼儿因食用这种奶粉而患肾结石。三聚氰胺中N原子的杂化形式是 。
下表是Na、Mg、Si、S、Br五种元素的单质的沸点,其中b、e均是热和电的良导体。
| 单质 |
a |
b |
c |
d |
e |
| 沸点(℃) |
58.8 |
882.9 |
444.7 |
2 355 |
1 107 |
(1) a的元素在元素周期表中的位置为________。
(2) 写出d的元素原子的电子式________;其最高价氧化物形成的晶体为________晶体(填类型),溶于强碱的离子方程式为________________________________________。
(3) c与氢形成的分子X的空间构型为________;写出X的水溶液与足量b元素的最高价氧化物对应水化物反应的离子方程式___________________________________。
(4) 上述元素所能形成的简单离子中半径最小的是________(填离子符号),最高价氧化物对应水化物酸性最强的是________(填分子式),e元素与N元素形成化合物的电子式为____________________________。
(5) b元素与氯元素形成的化合物Y的晶体中,1个晶胞内含有的基本微粒及个数是________。
已知:A、B、C、D四种短周期元素,其化合价最高正价数依次为1、4、5、7,已知B原子的核外次外层电子数为2。A、C原子的核外次外层电子数为8。D元素的最高价氧化物对应的水化物是已知含氧酸中酸性最强的酸。试回答下列有关的问题:
(1)写出C元素原子的价电子轨道表达式 ;D元素的价电子排布式 。
(2)已知B元素与氢元素形成的气态化合物在标准状况下的密度为1.161g·L-1,则在该化合物的分子中B原子的杂化方式为 。
(3)已知C、D两种元素形成的化合物通常有CD3、CD5两种。这两种化合物中一种为非极性分子,一种为极性分子,则属于极性分子的化合物的化学式是 。
(4)由B元素形成具有正四面体结构的晶体和由C元素形成具有正四面体结构的晶体相比,熔点较高的晶体是 (填写晶体的名称)。
(5)由A、D两元素形成的化合物组成的晶体中,阴、阳离子都具有或近似具有球型对称结构,它们都可以看作刚性圆球,并彼此“相切”。如下图所示为A、D形成化合物的晶胞结构图以及晶胞的剖面图: 若
若
a=5.6×10-8cm,则该晶体的密度为 g·cm-3(精确到小数点后1位)。
根据所学知识,回答以下问题:
(1)Ni(CO)4是无色液体,沸点42.1℃,熔点-19.3℃,难溶于水,易溶于有机溶剂推测Ni(CO)4是____________分子(填“极性”或“非极性”)。
(2)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。
①N2H4的结构式为 ;NH4+的空间构型是 。
②肼可用作火箭燃料,燃烧时发生的反应是:N2O4(l)+2N2H4(l)===3N2(g)+4H2O(g) △H=-1038.7 kJ·mol-1若该反应中有259.7kJ能量释放时,则形成的π键有______mol。
(3)硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如图所示:则Xm-的化学式为 ,硼原子轨道的杂化类型有 杂化,原子3的轨道杂化类型为 杂化,Na+与Xm-之间的作用力是 。
(4)BN晶体,具有熔沸点高,耐磨擦和较高的硬度等性质。则BN的晶体类型是 ,N的价层电子的电子排布图为 。
请回答下列问题:
(1)、
、
、
四种元素中,有一种元素的电离能数据如下:
| 电离能 |
(2)则该元素是(填写元素符号)。原子的电子排布式是。
的最高价氯化物分子式是。该元素可能的性质或应用有。
A.是一种活泼的金属元素
B.其电负性大于硫
C.其单质可作为半导体材料
D.其最高价氯化物的沸点低于其溴化物的沸点
关于化合物  ,下列叙述正确的有。
,下列叙述正确的有。
A.分子间可形成氢键
B.分子中既有极性键又有非极性键
C.分子中有7个键和1个
键
D.该分子在水中的溶解度大于2-丁烯
(4)的熔点
 的熔点(填>、<或=),其原因是
的熔点(填>、<或=),其原因是
卤族元素包括等。
(1)下列曲线表示卤族元素某种性质随核电荷数的变化趋势,正确的是。

(2)利用"卤化硼法"可合成含和
两种元素的功能陶瓷,下图为其晶胞结构示意图,则每个晶胞中含有
原子的个数为,该功能陶瓷的化学式为。

(3)和
中心原子的杂化方式分别为和。第一电离能介于
、
之间的第二周期元素有种。
(4)若与
通过
原子与
原子间的配位键结合形成配合物,则该配合物中提供孤对电子的原子是。
(1)依据第2周期元素第一电离能的变化规律,参照下图元素的位置,用小黑点标出
三种元素的相对位置。

(2)可由
和
在
催化剂存在下反应直接得到:
①上述化学方程式中的5种物质所属的晶体类型有(填序号)。
a.离子晶体 b.分子晶体 c.原子晶体 d.金属晶体
②基态铜原子的核外电子排布式为。
(3)与一定量水形成
晶体
,
在一定条件下可转化为
:
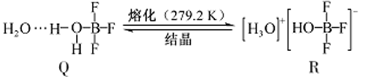
①晶体中各种微粒间的作用力不涉及(填序号)。
a.离子键 b.共价键 c.配位键 d.金属键 e.氢键 f.范德华力
②中阳离子的空间构型为,阴离子的中心原子轨道采用杂化。
(4)已知苯酚(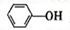 )具有弱酸性,其
)具有弱酸性,其=1.1 ×10-10;水杨酸第一级电离形成的离子
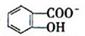 能形成分子内氢键。据此判断,相同温度下电离平衡常数
能形成分子内氢键。据此判断,相同温度下电离平衡常数(水杨酸
(苯酚)(填">"或"<"),其原因是。
元素位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素
基态原子的3p 轨道上有4个电子。元素
的原子最外层电子数是其内层的3倍。
(1)与
所形成化合物晶体的晶胞如右图所示。
①在1个晶胞中,离子的数目为。
②该化合物的化学式为。
(2)在的氢化物(
)分子中,
原子轨道的杂化类型是。
(3)的氢化物(
)在乙醇中的溶解度大于
,其原因是。
(4)与
可形成
①的空间构型为(用文字描述)。
②写出一种与互为等电子体的分子的化学式:。
(5)的氯化物与氨水反应可形成配合物
,1
该配合物中含有σ键的数目为。
元素X 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子的3p 轨道上有4个电子。元素Z 的原子最外层电子数是其内层的3倍。
(1)X与Y所形成化合物晶体的晶胞如图所示。
①在1个晶胞中,X离子的数目为 。
②该化合物的化学式为 。若其晶胞边长为540.0pm,则密度为 ,X与最近的Y之间的距离为
(2)在Y的氢化物(H2Y)分子中,Y原子轨道的杂化类型是 。
(3)Y 与Z 可形成YZ42-
①YZ42-的空间构型为 (用文字描述)。
②写出一种与YZ42-互为等电子体的分子的化学式: 。
(4)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有σ键的数目为 。
A、B、C、D、E、F、G七种元素,它们的原子序数依次增大,除G外均为前20号元素。A原子基态时p能级原子轨道上电子数等于次外能层电子数,C元素的原子基态时s能级与p能级上的电子数相等,C、D处于相同的能级,且D是同期中电负性最大的元素,E原子的第一至第四电离能(kJ·mol-1)分别为:578、1817、2745、11575,F元素原子中4s能级有2个电子。G元素的离子形成的硫酸盐结晶水合物呈蓝色。
(1)B形成的单质中σ键和Π键的个数比为 ,上述元素形成的化合物中和B的单质是等电子体的是__________(填化学式)
(2)G元素的基态原子的电子排布式为 。
(3)常温下,E单质投入到B的最高价氧化物对应的水化物的浓溶液中的现象是 。
(4)D、F组成的晶体FD2结构如图Ⅰ所示,G形成晶体的结构如Ⅲ所示,Ⅱ为H3BO3(硼酸)晶体结构图(层状结构,层内的H3BO3分子通过氢键结合)。
图Ⅰ 图Ⅱ 图Ⅲ
①图Ⅰ所示的FD2晶体中与F离子最近且等距离的F离子数为 ,图Ⅲ中未标号的G原子形成晶体后周围最紧邻的G原子数为 ;
②图Ⅱ所示的物质结构中最外能层已达8电子结构的原子是 (写元素符号),H3BO3晶体中B原子个数与极性键个数比为 ;
③三种晶体中熔点高低的顺序为 (填化学式),H3BO3晶体受热熔化时,克服的微粒之间的相互作用为 。
前四周期原子序数依次增大的元素A,B,C,D中,A和B的价电子层中未成对电子均只有1个,并且A-和B+的电子相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2。
回答下列问题:
(1)C的元素符号为 D2+的电子排布式为_______。
(2)四种元素中第一电离最小的是________,电负性最大的是________。(填元素符号)
(3)A、B和D三种元素组成的一个化合物的晶胞如图所示。
该化合物的化学式为_________;D的配位数为_______;该晶体的密度为_______g·cm-3。
(4)A-、B+和C3+三种离子组成的化合物B3CA6,其中化学键的类型有_____;该化合物中存在一个复杂离子,该离子的化学式为_______,配位体是____。
均由两种短周期元素组成的A、B、C、D化合物分子,都含有18个电子,它们分子中所含原子的数目依次为2、3、4、6。A和C分子中的原子个数比为1∶1,B和D分子中的原子个数比为1∶2。D可作为火箭推进剂的燃料。
请回答下列问题:
(1)A、B、C、D分子中相对原子质量较大的四种元素第一电离能由大到小排列的顺序为
(用元素符号回答)。
(2)A与HF相比,其熔、沸点较低,原因是 。
(3)B分子的空间构型为 形,该分子属于 分子(填“极性”或“非极性”) 。
(4)C为一种绿色氧化剂,有广泛应用。请写出Cu、稀H2SO4与C反应制备硫酸铜的离子方程式 ,该反应中反应物Cu的基态原子电子排布式为 。铜晶体中铜原子的堆积方式为面心立方堆积,下图是铜晶体一个晶胞的示意图,则晶胞中含 个铜原子。
(5)D分子中心原子的杂化方式是 ,由该原子组成的单质分子中包含
个π键,与该单质分子互为等电子体的常见分子的分子式为 。
本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
21.A.《物质结构与性质》
在5-氨基四唑( )中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊。
)中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊。

⑴基态Ga原子的电子排布式可表示为 ;
⑵5-氨基四唑中所含元素的电负性由大到小的顺序为 ,其中N原子的杂化类型为 ;在1 mol 5-氨基四唑中含有的σ键的数目为 。
⑶叠氮酸钠(NaN3)是传统安全气囊中使用的气体发生剂。
①叠氮酸钠(NaN3)中含有叠氮酸根离子(N3-),根据等电子体原理N3-的空间构型为 。
②以四氯化钛、碳化钙、叠氮酸盐作原料,可以生成碳氮化钛化合物。其结构是用碳原子取代氮化钛晶胞(结构如右图)顶点的氮原子,这种碳氮化钛化合物的化学式为 。
已知:①红磷在氯气中燃烧可以生成两种化合物——PCl3和PCl5,氮与氢也可形成两种化合物——NH3和NH5。
②PCl5分子中,P原子的1个3s轨道、3个3p轨道和1个3d轨道发生杂化形成5个sp3d杂化轨道,PCl5分子呈三角双锥形(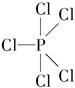 )。
)。
(1)NH3、PCl3和PCl5分子中,所有原子的最外层电子数都是8个的是________(填分子式),该分子空间构型是______________。
(2)有同学认为,NH5与PCl5类似,N原子的1个2s轨道、3个2p轨道和1个2d轨道可能发生sp3d杂化。请你对该同学的观点进行评价__________________________
(3)经测定,NH5中存在离子键,N原子最外层电子数是8,所有氢原子的最外层电子数都是2,则NH5的电子式是________。
(4)肼(N2H4)分子可视为NH3分子中的一个氢原子被——NH2(氨基)取代形成的另一种氮的氢化物。
①NH3分子空间构型为 ,N2H4分子中氮原子轨道的杂化类型是 。
②肼可用作火箭燃料,燃烧时发生的反应是:
N2O4(l)+2N2H4(l)===3N2(g)+4H2O(g);△H=-1 038.7 kJ·mol-1
若该反应中有4 mol N-H键断裂,则形成的π键有 mol。
③肼能与硫酸反应生成N2H6SO4,N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内不存在 (填标号)。
a.离子键 b.共价键
c.配位键 d.范德华力
试题篮
()