X、Y、Z、W是元素周期表前四周期中常见的元素,其相关信息如下表:
| 元素 |
相关信息 |
| X |
X原子基态时最外层电子数是其内层电子数的2倍 |
| Y |
Y原子基态时2p原子轨道上有3个未成对的电子 |
| Z |
Z的基态原子最外层电子排布式为:nsnnpn+2 |
| W |
W的原子序数为29 |
(1)基态W原子的价电子排布式是_________________。
(2)X、Y、Z三种元素第一电离能从大到小的顺序是____________。(填化学式)
(3)Y的氢化物分子的空间构型是_______________;该氢化物分子中Y原子轨道的杂化类型是___________。
(4)X的气态氢化物和Y的气态氢化物中沸点高的是 ,(填化学式)其主要原因是 。
(5)铅、钡、氧形成的某化合物的晶胞结构是:Pb4+处于立方晶胞顶点,Ba2+处于晶胞中心,O2-处于晶胞棱边中心,该化合物化学式为 ,每个Ba2+与 个O2-配位。
(13分) 下表为元素周期表的一部分,其中编号代表对应的元素。
请回答下列问题:
(1)写出元素⑦的基态原子排布式 ,元素⑧位于 区。
⑤元素原子的价层电子的轨道表示式为 ,
(2)若元素①③⑤形成的某化合物显酸性,经测定这三种元素的质量比为1:6:16,该化合物对氢气的相对密度为23,则其中所有杂化原子的杂化方式分别为 和 。
(3)元素④和⑥的第一电离能大小顺序是 > (用元素符号表示)。请写出由④和⑤两种元素形成的与N3-互为等电子体的离子的化学式 ,其VSEPR构型为 。
(4)在测定①和⑥形成的化合物的相对分子质量时,实验测得值一般高于理论值,其主要原因是 。
(5)④和⑧形成某种化合物的晶胞结构如右图所示(每个球均表示1个原子,其中④显-3价),则其化学式为 。
⑧的常见离子和④的最简单氢化物形成的配离子的名称为 ,
其水溶液颜色为 。
(10分,每空2分)决定物质性质的重要因素是物质的结构。请回答下列问题:
(1)已知A和B为第三周期元素,其原子的第一至第四电离如下表所示:
| 电离能/kJ·mol-1 |
I1 |
I2 |
I3 |
I4 |
| A |
578 |
1 817 |
2 745 |
11 578 |
| B |
738 |
1 451 |
7 733 |
10 540 |
A通常显____价,A的电负性__ __B的电负性(填“>”、“<”或“=”)。
(2)已知:波长为300 nm的紫外光的光子所具有的能量约为399 kJ·mol-1。根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因:
。
| 共价键 |
C—C |
C—N |
C—S |
| 键能/kJ·mol-1 |
347 |
305 |
259 |
(3)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是________________。
(4)某配合物的分子结构如图所示,其分子内不含有__________(填字母)。
A.离子键 B.共价键
C.金属键 D.配位键 E.氢键
(8分,每空2分)水是生命之源,它与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。
(1)写出与H2O分子互为等电子体的微粒___ ___(填1种)。
(2)水分子在特定条件下容易得到一个H+,形成水合氢原子(H3O+)。下列对上述过程的描述不合理的是 ( )
| A.氧原子的杂化类型发生了改变 | B.微粒的形状发生了改变 |
| C.微粒的化学性质发生了改变 | D.微粒中的键角发生了改变 |
(3)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是________(请用相应的编号填写)。
(4)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如下图所示),已知冰的升华热是51 kg/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能”是_____ ___kJ/mol;
(12分,每空2分)
当今世界,能源的发展日益成为全世界、全人类共同关心的问题。
(1)A和B的单质单位质量的燃烧热大,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
| 电离能(kJ/mol) |
I1 |
I2 |
I3 |
I4 |
| A |
899 |
1 757 |
14 840 |
21 000 |
| B |
738 |
1 451 |
7 733 |
10 540 |
①请根据上述信息,写出A基态原子的核外电子排布式:__________________。
②某同学根据上述信息,推断B的核外电子排布如图1所示,该同学所画的电子排布图违背了______________________。
(2)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。
①已知金刚石中C—C键的键长为154.45 pm,C60中C—C键的键长为145 pm和140 pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确并阐述理由____________________________ ________________。
②科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如图2所示,该物质在低温时是一种超导体。该物质中K原子和C60分子的个数比为______________________。
③继C60后,科学家又合成Si60、N60,C、Si、N原子电负性由大到小的顺序是__________ 。Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为______。
(8分,每空2分)自从1962年首次合成了第一个稀有气体的化合物XePtF6以来,人们又相继发现了氙气的一系列化合物如XeF2、XeF4等。巴特列为开拓稀有气体化学作出了历史性贡献。
(1)请根据XeF4的结构示意图判断这个分子是极性分子还是非极性分子?_________ 。
(2)XeF2晶体是一种无色晶体,下图为它的晶胞结构图。XeF2晶体属于哪种类型的晶体?_________;其堆积方式属于__________(填“钾型”“镁型”或“铜型”)。
(3)一个XeF2晶胞中实际拥有XeF2__________个。
A、B、C、D、E代表5种元素。请填空:
(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其元素符号为 ;
(2)B元素的负一价离子和C元素的正一价离子的电子层结构都与氩相同,B的元素符号为 ,C的元素符号为 ;
(3)D元素的正三价离子的3d亚层为半充满,D的元素符号为 ,其基态原子的电子排布式为 。
(4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,E的元素符号为 ,其基态原子的电子排布式为 。
(8分)A、B、C、D、E都是元素周期表中前20号元素,原子序数依次增大,B、C、D同周期,,A、D同主族,E和其它元素既不在同周期也不在同主族,B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水。
根据以上信息,回答下列问题:
(1)A和D氢化物中,沸点较低的是 (选填“A”或“D”);A和B的离子中,半径较小的是 (填离子符号)。
(2)元素C在元素周期表中的位置是 。
(3)A和E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如下图所示,阳离子(用“●”表示)位于该正方体的顶点或面心;阴离子(用“〇”表示)均位于小正方体中心。该化合物的电子式是 。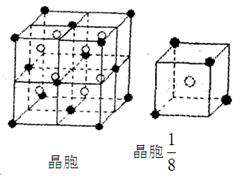
A、B、D、E是短周期中构成蛋白质的重要元素,其性质见下表。Fe、Co元素的常见化合价为+2、+3,能形成各种有色配离子。
| |
A |
B |
D |
E |
| 化合价 |
-4 |
-2 |
-3 |
-2 |
| 电负性 |
2.5 |
2.5 |
3.0 |
3.5 |
(1)基态Fe原子的电子排布式为 。
(2)Fe、Co两元素的第三电离能I3(Fe) I3(Co)(填“<”或“>”)。
(3)B、D、E的气态氢化物的沸点由高到低的顺序为 (填化学式)。
(4)Co与E形成的化合物晶胞如右图所示,则该化合物的化学式为 。(用元素符号表示)
(5)Co的离子能与AD-离子生成各种配合物。紫色的配离子[Co(AD)6]4-是一种相当强的还原剂,在加热时能与水反应生成[Co(AD)6]3-。
①HAD分子中A元素的杂化类型为 ,D元素的化合价为 。
②写出[Co(AD)6]4-在加热时与水反应生成[Co(AD)6]3-的离子方程式: 。
CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等。已知:
①CuCl可以由CuCl2用适当的还原剂如SO2、SnCl2等还原制得:
2Cu2++2Cl-+SO2+2H2O=2CuCl↓+4H++SO42-
2CuCl+SnCl2=2CuCl↓+SnCl4
②CuCl2溶液与乙二胺(H2N—CH2—CH2—NH2)可形成配离子[Cu(En)2]2+(En是乙二胺的简写):
请回答下列问题:
(1)配离子[Cu(En)2]2+的中心原子基态外围电子排布式为 ,
H、N、O三种元素的电负性由大到小的顺序是 ;
(2)SO2分子的空间构型为 ;
(3)乙二胺分子中氮原子轨道的杂化类型为 ,乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是 。
(4)配离子[Cu(En)2]2+的配位数为 ,该微粒含有的微粒间的作用力类型有 (填字母);
| A.配位键 | B.极性键 | C.离子键 | D.非极性键 |
E.氢键 F.金属键
(5)CuCl的晶胞结构如右图所示,其中Cl-的配位数(即与Cl-最近距离的Cu+的个数)为 。
已知:A、B、C、D、E、F五种元素核电荷数依次增大,属周期表中前四周期的元素。其中A原子核外有三个未成对电子;B在第三周期且化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中是最高的;F原子核外最外层电子数与B相同,位于第四周期第IB族,请根据以上信息,回答下列问题:
(1)A、B、C、D的第一电离能由小到大的顺序为 。(用元素符号表示)
(2)B的氯化物的熔点比D的氯化物的熔点 (填高或低),理由是 。
(3)E的最高价氧化物分子的空间构型是 。
(4)F的核外电子排布式是 ,F的高价离子与A的简单氢化物形成的配离子的化学式为 .
(5)A、F形成某种化合物的晶胞结构如图所示,则其化学式为 ;(黑色球表示F原子)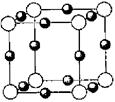
(6)A、C形成的化合物具有高沸点和高硬度,是一种新型无机非金属材料,其晶体中所含的化学键类型为 。
部分中学化学常见元素原子结构及性质如表所示
| 序号 |
元素 |
结构及性质 |
| ① |
A |
A在第三周期中简单离子半径最小 |
| ② |
B |
B原子最外层电子数是内层电子数的1/5 |
| ③ |
C |
C是常用化肥的主要元素,单质常温下呈气态 |
| ④ |
D |
通常情况下,D没有正化合价,A、B、C都能与D形成化合物 |
| ⑤ |
E |
E在周期表中可以排在IA族,也可以排在ⅦA族 |
(1)A原子中的电子占有______个轨道,最外层有______种不同运动状态的电子。这五种元素的原子半径由大到小的顺序为_________________(用元素符号表示)。
(2)E与D可以按原子个数比2:1、1:1形成两种化合物X、Y,区别X、Y这两种物质的实验方法为______________________________________。E与C组成的两种化合物M、N,所含电子数分别与X、Y相等,M的空间构型为___________,N的结构式为___________。
(3)C与D都是较活泼的非金属元素,用一个有关的化学方程式说明两种单质的氧化性强弱_____________________________________。
(4)有人认为A、B的单质用导线连接后插入NaOH溶液中可形成原电池,你认为是否可行,若可以,写出负极的电极反应式(若认为不行可不写)________________________。
A、B、C、D、E、F六种短周期元素的原子序数依次增大。A是宇宙中含量最丰元素,B元素的原子价电子排布为nsnnpn,D元素的最外层电子数是其电子层数的3倍,F的最高价氧化物对应水化物有两性,能溶于C、E的最高价氧化物对应水化物中。试回答
(1)写出C原子的价层电子轨道表示式: ;D原子的价层电子排布式:___________,E的原子结构示意图:___________;
(2)B位于元素周期表的第 族,A、B形成原子个数比1:1且直线形分子的结构式: ;
(3)C的基态原子核外有 种不同运动状态的电子;
(4)E单质在空气中燃烧生成物的电子式: ,其中的阳离子与阴离子的个数比是 ;
(5)F的固态氧化物的用途有________ ___(说出一种)。F的单质、石墨和二氧化钛(TiO2)按比例混合,高温下反应得到的两种化合物均由两种元素组成,且都是新型陶瓷材料(在火箭和导弹上有重要应用),其反应的化学方程式是 。
【化学—选:3:物质结构与性质】 已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大。A与其他4种元素既不在同一周期又不在同一主族。B和C属同一主族,D和E属同一周期,又知E是周期表中1—18列中的第7列元素。D的原子序数比E小5,D跟B可形成离子化合物,其晶胞结构如右图。
已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大。A与其他4种元素既不在同一周期又不在同一主族。B和C属同一主族,D和E属同一周期,又知E是周期表中1—18列中的第7列元素。D的原子序数比E小5,D跟B可形成离子化合物,其晶胞结构如右图。 请回答:
请回答: (1)A元素的名称是 ;
(1)A元素的名称是 ; (2)B元素原子核外运动状态不同的电子数为 ,C元素原子价电子层的电子排布图为 ,B与A形成的化合物比C 与A形成的化合物沸点高,其原因是
(2)B元素原子核外运动状态不同的电子数为 ,C元素原子价电子层的电子排布图为 ,B与A形成的化合物比C 与A形成的化合物沸点高,其原因是  (3)元素E在周期表中的位置是 ,它的+2价离子的电子排布式为 :
(3)元素E在周期表中的位置是 ,它的+2价离子的电子排布式为 :
(4)由以上五种元素的任意两种形成的常见化合物中,所含离子键成分最多的可能为  (5) 如图所示,D跟B形成的离子化合物晶体的密度为ag·cm-3,则晶胞的体积是
(5) 如图所示,D跟B形成的离子化合物晶体的密度为ag·cm-3,则晶胞的体积是
(只要求列出算式)。
氮是地球上极为丰富的元素
(1)Li3N晶体中氮以N3-的形式存在,基态N3-的电子排布式为 ;
(2)X离子中所有电子正好充满K.L.M三个电子层,它与N3-形成的晶体结构如右图所示。X的元素符号是______,X离子与N3-形成的化合物化学式为______。
(3)水是生命之源,它与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(为按顺序排序)。与冰的晶体类型相同的是______(请用相应的编号填写)
A B C D E
(4)在冰晶体中,每个水分子与相邻的4个水分子形成氢键,已知冰的升华热是51 kJ/mol,除氢键外,水分子间还存在范德华力(11kJ/mol),则冰晶体中氢键的“键能”是 kJ/mol;
试题篮
()