(物质结构与性质)
Ⅰ.下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
试回答下列问题:
(1)请写出元素D的基态原子电子排布式___________________。
(2)元素A、B形成的单质中,______对应的单质熔点更高,原因是_________________。
(3)写出C的最高价氧化物的水化物与B的最高价氧化物的水化物反应的化学方程式_______________。
(4)元素D可以形成化学式为D(NH3)5BrSO4,配位数均为6的两种配合物。若往其中一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时,产生淡黄色沉淀,则该配合物的化学式为____________。
Ⅱ.钇钡铜氧的晶胞结构如图。研究发现,此高温超导体中的铜元素有两种价态:+2价和+3价。
(5)根据图示晶胞结构,推算晶体中Y,Ba,Cu和O原子个数比,确定其化学式为________。
Ⅲ.BF3与一定量的水形成晶体Q [(H2O)2·BF3],Q在一定条件下可转化为R: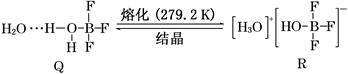
(6)晶体Q中各种微粒间的作用力不涉及________(填字母)。
a.离子键
b.共价键
c.配位键
d.金属键
e.氢键
f.范德华力
(7)R中阳离子的空间构型为________,阴离子的中心原子轨道采用_____杂化。
X、Y、Z、M、W是原子序数依次增大的前四周期元素,X元素原子核外有三个能级,各能级电子数相等,Y的单质在空气中燃烧生成一种淡黄色的固体;Z元素原子的最外层电子数比次外层电子数少2,M原子外围电子排布式为3dn4sn;W的内层电子已全充满,最外层只有2个电子。请回答:
(1)X元素在周期表中的位置是 ;
W2+离子的外围电子排布式为 。
(2)X 能与氢、氮、氧三种元素构成化合物 XO(NH2)2,其中X原子和N原子的杂化方式为分别为 、 ,该化合物分子中的 键与
键与 键的个数之比是 ;该物质易溶于水的主要原因是 。
键的个数之比是 ;该物质易溶于水的主要原因是 。
(3)已知Be和Al元素处于周期表中对角线位置,化学性质相似,请写出Y元素与Be的最高价氧化物的水化物相互反应的化学方程式
(4)M晶体的原子堆积方式为六方堆积(如图所示),则晶体中M原子配位数是 。某M配合物化学式是[M(H2O)5Cl]Cl2·H2O,1 mol该配合物中含配位键的数目是 。
(5)X 的某种晶体为层状结构,可与熔融金属钾作用。钾原子填充在各层之间,形成间隙化合物,其常见结构的平面投影如图①所示,则其化学式可表示为 。
(6)Y离子和Z离子比较,半径较大的是___(写离子符号),元素Y与元素Z形成的晶体的晶胞结构是如图②所示的正方体,设晶胞中最近的两个Z离子的距离为a cm ,该化合物的摩尔质量为bg/ mol ,则该晶胞密度的计算式为 。(只要求列算式,不必计算出数值,阿伏伽德罗常数用NA表示)。
C、N、O是中学化学常见的三种元素,请回答下列问题:
(1)写出基态O2-的核外电子排布式______________________________。
(2)C、N、O三种元素的第一电离能由大到小的顺序为_____________________________。
(3)光气( )分子中含有______个
)分子中含有______个 键,____个
键,____个 键,其中C原子的杂化方式为_______。
键,其中C原子的杂化方式为_______。
(4)水的熔点比H2S的熔点高,其原因是________________。
(5)超硬材料氮化销的晶胞如图 所示,则氮化铂的化学式为_______。
所示,则氮化铂的化学式为_______。
决定物质性质的重要因素是物质结构。请回答下列问题。
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
| 电离能/kJ·mol-1 |
I1 |
I2 |
I3 |
I4 |
| A |
578 |
1817 |
2745 |
11578 |
| B |
738 |
1451 |
7733 |
10540 |
A通常显 价,A的电负性 B的电负性(填“>”、“<”或“=”)。
(2)紫外光的光子所具有的能量约为399 kJ·mol-1。根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因: 。组成蛋白质的最简单的氨基酸中的碳原子杂化类型是 。
| 共价键 |
C-C |
C-N |
C-S |
| 键能/ kJ·mol-1 |
347 |
305 |
259 |
(3)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如右图所示),已知3种离子晶体的晶格能数据如下表:
| 离子晶体 |
NaCl |
KCl |
CaO |
| 晶格能/kJ·mol-1 |
786 |
715 |
3401 |
则该4种离子晶体(不包括NaCl)熔点从高到低的顺序是: 。
其中MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有 个。
(4)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是 。
(5)某配合物的分子结构如右图所示,其分子内不含有 (填序号)。
A.离子键 B.极性键 C.金属键
D.配位键 E.氢键 F.非极性键
已知A、B、C、D、E、F为元素周期表中原子序数依次增大的前20号元素,A与B;C、D与E分别位于同一周期。A原子L层上有2对成对电子, B、C、D的核外电子排布相同的简单离子可形成一种C3DB6型离子晶体X,,CE、FA为电子数相同的离子晶体。
(1)写出A元素的基态原子价电子排布式 ;F离子电子排布式 。
(2)写出X的化学式
(3)试解释工业冶炼D不以DE3而是以D2A3为原料的原因: 。
(4)CE、FA的晶格能分别为786 KJ/mol l、3401KJ/mo,试分析导致两者晶格能差异的主要原因是: 。
(5)F与B可形成离子化合物,其晶胞结构如图所示:F与B形成离子化合物的化学式为________;该离子化合物晶体的密度为a g/cm3,则晶胞的体积是________________(只要求列出算式)。
试题篮
()