下图所示的五元环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素,五种化合物由五种短周期元素形成,每种化合物仅含两种元素,A是沼气的主要成分,B、E分子中所含电子数均为18,B不稳定,具有较强的氧化性,其稀溶液是医疗上广泛使用的消毒剂,E的分子结构模型为 ,C、D均为原子晶体,C可作为光导纤维的主要材料,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2。根据以上信息回答下列问题:
,C、D均为原子晶体,C可作为光导纤维的主要材料,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2。根据以上信息回答下列问题:
①B的水溶液呈弱酸性,其主要的电离方程式可表示为_________ ,D的化学式是_____ __。
②A、B、E中均含有的一种元素为___________ (填元素名称) 。
③E电子式为_________________。
④液态B与液态E反应可生成一种气态单质和一种常见液体,1molB参加反应放出热量QkJ,其反应的热化学方程式为_______ _______。
⑤NH3分子中的N原子有一对孤对电子,能发生反应:NH3+HCl=NH4Cl。试写出E与足量盐酸时,发生反应的化学方程式 。
【化学一物质结构与性质】(15分)周期表中前四周期元素R、W、X、Y、Z的原子序数依次递增。R的基志原子中占据哑铃形原子轨道的电子数为1;W的氢化物的沸点比同族其它元素氢化物的沸点高;X2+与W2-具有相同的电子层结构;Y元素原子的3P能级处于半充满状态;Z+的电子层都充满电子。请回答下列问题:
(1)写出Z的基态原子外围电子排布__________。
(2)R的某种钠盐晶体,其阴离子Am-(含R、W、氢三种元素)的球棍模型如上图所示:在Am-中,R原子轨道杂化类型有_______;m=_____。(填数字)
(3)经X射线探明,X与W形成化合物的晶体结构与NaCl的晶体结构相似,X2+的配位原子所构成的立体几何构型为____________。
(4)往Z的硫酸盐溶液中加入过量氨水,可生成[Z(NH3)4]SO4,下列说法正确的是_______。
| A.[Z(NH3)4]SO4中所含的化学键有离子键、极性键和配位键 |
| B.在[Z(NH3)4]2+中Z2+给出孤对电子,NH3提供空轨道 |
| C.[Z(NH3)4]SO4组成元素中第一电离能最大的是氧元素 |
| D.SO42-与PO43-互为等电子体,空间构型均为四面体 |
(5)固体YCl5的结构实际上是YCl4+和YCl6-构成的离子晶体,其晶体结构与CsCl相似.若晶胞边长为apm,则晶胞的密度为____g•cm-3。(已知阿伏伽德罗常数为NA,用含a和NA的代数式表示)
[《物质结构与性质》选考题]现代世界产量最高的金属是Fe、Al、Cu。
(1)Fe、Al、Cu三种元素第一电离能由高到低的排序为 ;Fe2+的电子排布式为 。
(2)Cu(OH)2溶于浓氨水形成 色铜氨溶液;乙二酸( )分子中碳原子杂化类型为 ,分子中σ键比π键多 个。
)分子中碳原子杂化类型为 ,分子中σ键比π键多 个。
(3)以下变化伴随化学键破坏的是 (填下列选项标号)
| A.冰融化 | B.铝气化 | C.AlCl3溶于水 | D.胆矾受热变白 |
(4)二氧化硅晶体结构示意图如下,每个氧原子最近且等距离相邻 个氧原子。
下表为长式周期表的一部分,其中的编号代表对应的元素。
| ① |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |
② |
|
|
|
|
|
|
|
|
|
|
|
③ |
|
|
|
|
| |
④ |
|
|
|
|
|
|
|
|
|
|
⑤ |
|
|
⑥ |
⑦ |
|
| |
⑧ |
|
|
|
|
|
⑨ |
|
|
⑩ |
|
|
|
|
|
|
|
请回答下列问题:
(1)表中属于d区的元素是 (填编号)。
(2)表中元素①的6个原子与元素③的6个原子形成的某种环状分子名称为 ;
(3)④ ⑤ ⑥ ⑦四种元素的第一电离能由大到小的顺序是 (用元素符号表示)。
(4)按原子轨道的重叠方式,③与⑥形成的化合物中σ键有 个,π键有 个。
(5)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的孤对电子数为 ;该元素与元素①形成的分子X的空间构形为 ,属于 分子(填“极性”或“非极性”)。
(6)某些不同族元素的性质也有一定的相似性,如上表中元素⑤与元素②的氢氧化物有相似的性质。请写出元素②的氢氧化物与NaOH溶液反应的化学方程式: 。
(7)1183 K以下⑨元素形成的晶体的基本结构单元如图1所示,1183 K以上转变为图2所示结构的基本结构单元,在两种晶体中最邻近的原子间距离相同。

在1183 K以下的晶体中,与⑨原子等距离且最近的⑨原子数为______个,在1183 K以上的晶体中,与⑨原子等距离且最近的⑨原子数为________。
下表为元素周期表的一部分,其中编号代表对应的元素。

请回答下列问题:
(1)写出元素⑦的基态原子外围电子排布式 ,元素⑧位于 区。
⑤元素原子的价层电子的电子排布图为 ,
(2)若元素①③⑤形成的某化合物显酸性,经测定这三种元素的质量比为1:6:16,该化合物对氢气的相对密度为23,则其中所有杂化原子的杂化方式分别为 和 。
(3)元素③④⑤⑥的第一电离能由大到小的顺序是 (用元素符号表示)。请写出由④和⑤两种元素形成的与N3ˉ互为等电子体的分子的化学式 ,(写出一种即可)其VSEPR构型为 。
(4)ZnS的晶胞结构如图1所示,在ZnS晶胞中, 的配位数为 。
的配位数为 。
(5)铜能与类卤素(SCN)2分子(与氯气分子性质相似)反应生成Cu(SCN)2,1m ol(SCN)2分子中含有共价键的数目为 。
铜与金形成的金属互化物结构如图2,其晶胞边长为a nm,该金属互化物的密度为 (用含“a、NA的代数式表示)g· 。
。

(12分)X、Y、Z、R为短周期元素且原子序数依次增大。X、R原子核外电子层数等于其最外层电子数,Y元素的基态原子中电子分布在3个不同的能级,且每个能级中的电子总数相同;Z的两种同素异形体都存在于大气中,对生命起着重要作用。另有M元素位于周期表的第4周期第6列。请回答下列问题:
(1)上述5种元素中,电负性最大的是(填名称) ,X3Z+的VSEPR模型名称是 。
(2)M基态原子的电子排布式是 ;
(3)R的单质为面心立方最密堆积(见下图),则一个晶胞中R原子数为 ,R的配位数是 。
(4)已知:M2Z3与R2Z3结构和性质相似,则M2Z3溶于强碱时发生反应的离子方程式是 .
本题包括两道题
(1)下面是s能级p能级的原子轨道图,试回答问题: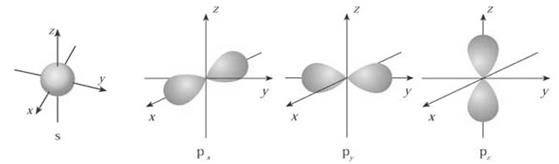
s电子的原子轨道呈 形,每个s能级有 个原子轨道;
p电子的原子轨道呈 形,每个p能级有 个原子轨道。
(2)A、B、C、D、E都是元素周期表中前20号的元素,原子序数依次增大,B、C、D同周期,A、D同主族,E和其它元素既不在同周期也不在同主族,B、C、D的最高价氧化物的水化物两两混合均能发生反应生成盐和水。A和E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如下图所示,阳离子(用“●”表示)位于该正方体的顶点或面心;阴离子(用“○”表示)位于小正方体的中心。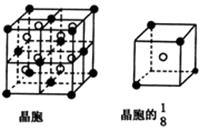
根据以上信息,回答下列问题:A至E的元素名称:
A ;B ;C ;D ;E
、
、
、
为原子序数依次增大的四种元索,
和
具有相同的电子构型;
、
为同周期元索,
核外电子总数是最外层电子数的3倍;
元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是(填元素符号),其中原子的核外电子排布式为。
(2)单质有两种同素异形体,其中沸点高的是(填分子式),原因是;
和
的氢化物所属的晶体类型分别为和。
(3)和
反应可生成组成比为1:3的化合物
,
的立体构型为,中心原子的杂化轨道类型为。
(4)化合物的立体构型为,中心原子的价层电子对数为,单质D与湿润的
反应可制备
,其化学方程式为。
(5)和
能够形成化合物
,其晶胞结构如图所示,晶胞参数,
=0.566
,
的化学式为:晶胞中
原子的配位数为;列式计算晶体F的密度(
)。
氟在自然界中常以的形式存在。
(1)下列关于的表述正确的是。
a.与
间仅存在静电吸引作用
b.的离子半径小于
,则
的熔点高于
c.阴阳离子比为2:1的物质,均与晶体构型相同
d.中的化学键为离子键,因此
在熔融状态下能导电
(2)难溶于水,但可溶于含
的溶液中,原因是(用离子方程式表示)。
已知在溶液中可稳定存在。
(3)通入稀NaOH溶液中可生成
,
分子构型为,其中氧原子的杂化方式为。
(4)与其他卤素单质反应可以形成卤素互化物,例如
、
等。已知反应
,
键的键能为
,
键的键能为
,则
中
键的平均键能为
。
的熔、沸点比
的(填"高"或"低")。
(15分)元素周期表第ⅤA族元素包括氮、磷、砷(As)、锑(Sb)等。这些元素无论在研制新型材料,还是在制作传统化肥、农药等方面都发挥了重要的作用。请回答下列问题:
(1)N4分子是一种不稳定的多氮分子,这种物质分解后能产生无毒的氮气并释放出大量能量,能被应用于制造推进剂或炸药。N4是由四个氮原子组成的氮单质,其中氮原子采用的轨道杂化方式为sp3,该分子的空间构型为________,N—N键的键角为________。
(2)基态砷原子的最外层电子排布式为________。
(3)N、P、As原子的第一电离能由大到小的顺序为____________(用元素符号表示)。
(4)叠氮化钠(NaN3)用于汽车安全气囊中氮气的发生剂,写出与N3-互为等电子体的分子的化学式________(任写一种即可)。
(5)天然氨基酸的命名常用俗名(根据来源与性质),例如,最初从蚕丝中得到的氨基酸叫丝氨酸[HOCH2CH(NH2)COOH]。判断丝氨酸是否存在手性异构体?________(填“是”或“否”)
(6)砷化镓为第三代半导体,以其为材料制造的灯泡寿命长,耗能少。已知立方砷化镓晶胞的结构如图所示,其晶胞边长为c pm,则密度为_______g·cm-3(用含c的式子表示,设NA为阿伏加德罗常数的值),a位置As原子与b位置As原子之间的距离为________pm(用含c的式子表示)。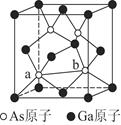
(12分)【选做题】本题包括A、B两小题,请选定一中一小题,并在相应的答题区域内作答。若多做,则按A小题评分。
A.[物质结构与性质]下列反应曾用于检测司机是否酒后驾驶:
2Cr2O72-+3CH3CH2OH+16H++13H2O→4[Cr(H2O)6]3++3CH3COOH
(1)Cr3+基态核外电子排布式为_________;配合物[Cr(H2O)6]3+中,与Cr3+形成配位键的原子是________(填元素符号)。
(2)CH3COOH中C原子轨道杂化类型为______________;1molCH3COOH分子中含有δ键的数目为______。
(3)与H2O互为等电子体的一种阳离子为________(填化学式);H2O与CH3CH3OH可以任意比例互溶,除因为它们都是极性分子外,还因为___________。
第VA族元素及其化合物在生产、生活中有着广泛的应用
(1)砷的电子排布式为 ,N、P、As三种元素的最常见氢化物沸点由高到低的顺序为 ,高纯度砷可用于生产半导体材料GaAs,在GaAs晶体中,Ga、As原子最外电子层均达到8电子稳定结构,则GaAs晶体中砷的配位数为 。
(2)对硝基苯酚水合物是一种具有特殊功能的物质,其结构简式为 。该物质中几种元素的第一电离能由大到小的顺序是 ,该物质的晶体中肯定不存在的作用力是 。
。该物质中几种元素的第一电离能由大到小的顺序是 ,该物质的晶体中肯定不存在的作用力是 。
a.氢键 b.极性键 c.范德华力 d.离子键 e.σ键
(3)科学家将NaNO3和Na2O在一定条件下反应得到一种白色晶体,已知其中阴离子与SO42-互为等电子体,则该阴离子的化学式是 。
(4)PM2. 5富含大量的有毒、有害物质,易引发二次光化学烟雾污染,光化学烟雾中含有NOx、O3、CH2=CHCHO、HCOOH、CH3COOONO2 (PAN)等二次污染物。
①N2O结构式可表示为N=N=O,N2O中氮原子的杂化轨道类型为 ,1 mol PAN中含σ键数目为 。
②测定大气中PM2.5的浓度方法之一是β-射线吸收法,β-射线放射源可用85 Kr。Kr晶体为面心立方晶体,若晶体中与每个Kr原子相紧邻的Kr原子有m个,晶胞中含Kr原子为n个,则 = (填数字)。已知Kr晶体的密度为ρg/cm3,摩尔质量为Mg/mol,阿伏伽德罗常数用NA表示,列式表示Kr晶胞参数a = nm。
= (填数字)。已知Kr晶体的密度为ρg/cm3,摩尔质量为Mg/mol,阿伏伽德罗常数用NA表示,列式表示Kr晶胞参数a = nm。
A、B、C、D、E、R六种元素位于周期表的前四周期,其原子序数依次增大。已知A原子核外有三个未成对电子;B的最外层电子数是内层电子数的3倍;化合物C2E的晶体为离子晶体;D单质的熔点在同周期单质中最高;E原子核外的M层中只有两对成对电子;R原子核外最外层电子数与C相同,其余各层均充满。请根据以上信息,回答下列问题:
(1)A、B、C、D四种原子的第一电离能由小到大的顺序为______(用元素符号表示)。
(2)C的氯化物的熔点比D的氯化物的熔点高,理由是 。
(3)基态R+离子的核外电子排布式是 。
(4)Q分子是A2B的等电子体,Q的结构式为 。
(5)图一是R单质的晶胞结构,配位数为 ;图二是B、R两元素组成的一种化合物的晶胞,其化学式为 。

〔化学——选修3:物质结构与性质〕举世瞩目的中国探月工程三期再入返回试验器于2014年10月24日凌晨成功发射,为实现月球采样和首次地月往返踏出了成功的第一步。探月工程三期的主要目标是实现无人自动采样返回,突破月面采样、月面上升、月球轨道交会对接等核心关键技术。已知所用火箭推进剂为肼(N2H4)和过氧化氢(H2O2),火箭箭体一般采用钛合金材料。
请回答下列问题:
(1)N2H4、H2O2分子中电负性最大的元素在周期表中的位置为 ,第一电离能最大的元素为 。
(2)钛的原子序数为22,其基态电子排布式示意图为 。
(3)1 mol N2H4分子中含有的键数目为 。
(4)H2O2分子结构如图1,其中心原子杂化轨道为 ,估计它难溶于CS2,简要说明原因 。

(5)氮化硼其晶胞如图2所示,则处于晶胞顶点上的原子的配位数为 ,若立方氮化硼的密度为g·cm-3,阿伏加德罗常数为NA,则两个最近N原子间的距离为________cm。

(12分)【化学—物质结构与性质】
(1)下列叙述正确的是________。
a.含有金属阳离子的晶体一定是离子晶体
b.化合物硫氰化铁和氢氧化二氨合银中都存在配位键
c.KCl、HF、CH3CH2OH、SO2都易溶于水,且原因相同
d.MgO的熔点比NaCl的高,主要是因为MgO的晶格能大于NaCl的晶格能
(2)氨基酸是蛋白质的基石,甘氨酸是最简单的氨基酸(结构如图),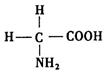
在甘氨酸分子中,N 原子的杂化形式是_____,在甘氨酸分子中C、N、O原子的第一电离能从大到小的顺序是_______;氮可以形成多种离子,如N3-、NH2-、NH4+、N2H5+等,其中,NH4+的空间构型是____。
(3)已知MO与CsCl的结构相似(如图所示),MO晶体的密度为p g·cm-3,NA为阿伏加德罗常数,相邻的两个M2+的核间距为acm。写出Cs基态原子的价电子排布式______,MO的相对分子质量可以表示为_____。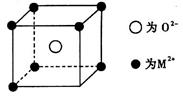
试题篮
()