在0.1mol/L的NaHCO3溶液中,下列关系式正确的是( )
| A.c(Na+)>c(HCO3-)>c(CO32-)>c(OH-) |
| B.c(Na+)+ c(H+)=c(HCO3-)+c(OH-) |
| C.c(H2CO3)+c(H+)=c(OH-)+c(CO32-) |
| D.c(Na+)=c(HCO3-)+2c(CO32-)+c(H2CO3) |
已知H2(g)+I2(g)  2HI(g) ΔH<0。有相同容积的定容密闭容器甲和乙,甲中加入H2和I2各0.1 mol,乙中加入HI 0.2 mol,在相同温度下分别达到平衡。现欲使甲中HI平衡时的百分含量大于乙中HI平衡时的百分含量,则应采取的措施是( )
2HI(g) ΔH<0。有相同容积的定容密闭容器甲和乙,甲中加入H2和I2各0.1 mol,乙中加入HI 0.2 mol,在相同温度下分别达到平衡。现欲使甲中HI平衡时的百分含量大于乙中HI平衡时的百分含量,则应采取的措施是( )
| A.甲中充入HI气体,乙中不变 | B.甲降低温度,乙增大压强 |
| C.甲中加入0.1 mol He,乙中不变 | D.甲增加0.1 mol H2,乙增加0.1 mol I2 |
在一体积固定的密闭容器中通入2mol A和1mol B,一定条件下发生如下反应:
2A(g)+B(g)  3C(g) ΔH<0,反应达到平衡后,改变一个条件(x),下列量(y)一定符合图中曲线的是( )
3C(g) ΔH<0,反应达到平衡后,改变一个条件(x),下列量(y)一定符合图中曲线的是( )

下列有关说法正确的是( )
| A.燃料电池工作时,燃料在负极被还原 |
| B.氯碱工业采用的是以铜为电极,阳离子交换膜来电解饱和食盐水 |
C. 有Mg、Al和NaOH溶液组成的原电池,其负极为铝,电极反应为Al-3e- = Al3+ 有Mg、Al和NaOH溶液组成的原电池,其负极为铝,电极反应为Al-3e- = Al3+ |
| D.二次电池充电时,电池负极连接到外接电源的负极 |
已知:H2(g)+Cl2(g)==="2HCl(g)" ΔH=-Q kJ·mol-1(Q>0),下列说法正确的是( )
| A.在一定条件下,1个氢气与1个氯气反应生成2个氯化氢放出Q kJ热量 |
| B.在一定条件下,1 mol氢气与1 mol氯气反应生成2 mol液态氯化氢放出Q kJ热量 |
| C.在相同条件下,1 mol氢气与1 mol氯气的能量总和大于2 mol氯化氢气体的能量 |
| D.在标准状况下,1L氢气和1 L氯气完全反应生成2L氯化氢气体放出QkJ热量 |
一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率,且不影响生成氢气的总量,可向盐酸中加入适量的
①NaOH(固体) ②H2O ③HCl ④CH3COONa(固体)
| A.①② | B.②③ | C.③④ | D.②④ |
下列叙述正确的是
| A.100℃纯水在pH=6,所以水在100℃时呈酸性 |
| B.pH=3的盐酸溶液,稀释至10倍后pH>4 |
| C.0.2mol·L-1的醋酸与等体积水混合后pH=1 |
| D.pH=3的盐酸与pH=11的氢氧化钠等体积混合后pH=7 |
下列所用材料不属于合金的是
| A.家用的铝窗 | B.建筑用的钢筋 | C.铸造用的黄铜 | D.温度计用的水银 |
在2A(g)+B(g)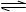 3C(g)+4D(g)反应中表示该反应速率最快的是 ( )
3C(g)+4D(g)反应中表示该反应速率最快的是 ( )
A.v(A)="0.5mol/(L·" s) B.v(B)="0.3mol/(L·" s)
C.v(C)="0.8mol/(L·" s) D.v(D)="1mol/(L·" s)
用于制造隐形飞机的某种物质具有吸收微波的功能,其主要成分的结构如下:( )

| A.无机物 | B.烃 | C.高分子化合物 | D.有机物 |
将纯水加热至较高温度,下列叙述正确的是
| A.水的离子积变大、pH变小、呈酸性 |
| B.水的离了积不变、pH不变、呈中性 |
| C.水的离子积变小、pH变大、呈碱性 |
| D.水的离子积变大、pH变小、呈中性 |
下列关于化学实验基本操作的叙述中,正确的是
| A.加热蒸发时,蒸发皿必须垫石棉网 |
| B.制Fe(OH)3胶体时,将饱和FeCl3溶液加热煮沸 |
| C.分液时,放出分液漏斗下层液体后,再继续放出上层液体 |
| D.蒸馏时,在烧瓶中加入沸石或碎瓷片,以防止液体暴沸 |
下列关于物质用途的说法中,不正确的是
| A.氨可用作制冷剂 |
| B.氧化铝可用作耐火材料 |
| C.晶体硅可用于制造光导纤维 |
| D.硅酸钠可用于制备硅胶和木材防火剂等 |
下列药品可用带玻璃塞的试剂瓶存放的是
| A.NaOH溶液 | B.Na2CO3溶液 | C.盐酸 | D.水玻璃 |
下列气体遇空气变红棕色的是
| A.SO2 | B.Cl2 | C.CO2 | D.NO |
试题篮
()