在稀硫酸中加入铜粉,铜粉不溶,再加入下列物质:①FeCl3;②Fe2O3;③Cu(NO3)2;④KNO3,铜粉溶解的是
| A.只有①或② |
| B.只有②或④ |
| C.只有①或②或③ |
| D.上述四种物质中任意一种 |
已知某碱性硼化钒(VB3)一空气电池工作时发生反应为:11O2+4VB2=2V2O5+4B2O3。以该电池作为电源,使用惰性电极电解硫酸铜溶液,实验装置如图所示。当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是
| A.VB2电极发生的电极反应为:2VB2+11H2O-22e-=V2O5+2B2O3+22H+ |
| B.若B装置内的液体体积为400mL,则CuSO4溶液的物质的量浓度为0.025mol/L |
| C.电解过程中,b电极表面先有红色物质析出,然后有气泡产生 |
| D.外电路中电子由a电极流向b电极 |
为探究外界条件对反应:mA(g)+nB(g) cZ(g) △H的影响,以A和B物质的量之比为m∶n开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如下图所示。下列判断正确的是
cZ(g) △H的影响,以A和B物质的量之比为m∶n开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如下图所示。下列判断正确的是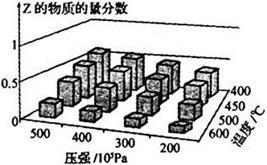
| A.在恒温恒压条件下,向已达到平衡的体系中加入少量Z,达新平衡时,Z的物质的量分数增大 |
| B.升高温度,正、逆反应速率都增大,平衡常数增大 |
| C.△H>0 m+n>c |
| D.温度不变,减小压强,平衡逆向移动,达新平衡时,A的浓度比原平衡减小 |
下列实验中,对应的现象以及结论都正确且两者具有因果关系的是
| 选项 |
实验 |
现象 |
结论 |
| A |
将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液 |
有气体生成,溶液呈血红色 |
稀硝酸将Fe氧化为Fe3+ |
| B |
将铜粉加1.0mol·L-1Fe2(SO4)3溶液中 |
溶液变蓝、有黑色固体出现 |
金属铁比铜活泼 |
| C |
用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热 |
熔化后的液态铝滴落下来 |
金属铝的熔点较低 |
| D |
将SO2通入酸性KMnO4溶液中 |
溶液的紫色褪去 |
SO2具有还原性 |
NA为阿伏加德罗常数的值。下列说法正确的是
| A.1L 0.1mol·L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA |
| B.50ml 12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA |
| C.过氧化钠与CO2反应时,生成0.1mol氧气转移的电子数为0.2NA |
| D.密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA |
下列反应的离子方程式书写正确的是
| A.钠与水反应:Na+2H2O=Na++2OH-+H2↑ |
| B.向Al2(SO4)3溶液中加入过量NH3∙H2O:Al3++4NH3∙H2O=AlO2-+4NH4++2H2O |
| C.酸性溶液中KClO3与KCl反应生成Cl2:ClO3-+Cl-+6H+=Cl2↑+3H2O |
| D.向含1molNaHSO3的溶液中加入1molNa2O2:Na2O2+HSO3-=2Na++SO42-+OH- |
镁铝合金5.1 g溶于300mL2mol/L的HCl,在标准状况下放出气体的体积为5.6L。向反应后的溶液中加入足量氨水,产生沉淀的质量为( )
| A.5.1g | B.10.2g | C.13.6g | D.15.3g |
某溶液中有Fe3+、Mg2+、Fe2+和Al3+四种阳离子,若向其中加入过量的氢氧化钠溶液,搅拌后,再加入过量的盐酸,溶液中大量减少的阳离子是( )
| A.Fe3+ | B.Mg2+ | C.Fe2+ | D.Al3+ |
某溶液中含有NH4+、SO32-、SiO32-、Br-、CO32-、Na+,向该溶液中通入过量的Cl2,下列判断不正确的是:
| A.溶液中共发生了1个氧化还原反应 |
| B.反应前后,溶液中离子浓度基本保持不变的有NH4+、Na+ |
| C.有胶状物质生成 |
| D.溶液颜色发生变化 |
氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中反应制得:①3SiO2+6C+2N2 Si3N4+6CO,也可由SiCl4的蒸汽和NH3反应制取:
Si3N4+6CO,也可由SiCl4的蒸汽和NH3反应制取:
②3SiCl4+4NH3 Si3N4+12HCl.则下列叙述正确的是
Si3N4+12HCl.则下列叙述正确的是
| A.反应②属于离子反应 |
| B.若制取等量的Si3N4,则反应①②转移电子数目必然相等 |
| C.反应①的氧化剂是N2 |
| D.反应①中氧化产物与还原产物物质的量之比为1:6 |
已知适当条件下+7、+6、+4价锰的化合物都能和浓盐酸反应制得氯气且还原产物都是MnCl2.将6.32g KMnO4粉末加热一段时间后收集到0.112L气体(标准状况,后同),冷却后放入足量的浓盐酸再加热,又收集到VL黄绿色气体,下列说法正确的是
| A.V=2.24L |
| B.参加反应的HCl为0. 18mol |
| C.无法确定最终生成含钾化合物的数量是多少 |
| D.6.32g KMnO4粉末若直接与足量浓盐酸反应可得到2.24L Cl2(标准状况) |
若NA为阿伏加德罗常数的值,下列说法正确的是
| A.NA个Fe(OH)3胶体粒子的质量为107g |
| B.8.0gCu2S和CuO的混合物中含有铜原子数为0.1NA |
| C.标准状况下,将2.24L Cl2溶于水,可得到HClO分子的数目是0.1NA |
| D.5.6gFe与0.1mol Cl2完全反应,反应中转移的电子数为0.3NA |
试题篮
()