溶质的质量分数分别为5 %和25%的H2SO4溶液按等体积混合均匀后,所得溶液中H2SO4的质量分数为( )
| A.15 % | B.30 % | C.>15% | D.<15 % |
下列叙述正确的是
A.已知I3- I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫红色,说明KI3在CCl4中的溶解度比在水中的大 I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫红色,说明KI3在CCl4中的溶解度比在水中的大 |
B.室温下向10mL pH =3的醋酸溶液中加水稀释后,溶液中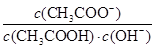 减小 减小 |
| C.室温时ka(HF)=3.6×10-4,ka(CH3COOH)=1.75×10-5,0.1 mol /L的NaF溶液与0.1 mol /L的CH3COOK溶液相比,一定有c(Na+) -c(F-)<c(K+)-c(CH3COO-)成立 |
D.在25℃时,将amol/L的氨水与0.01 mol/L的盐酸等体积混合,充分反应后溶液中c(NH4+)=c(Cl-),则25℃时NH3 • H2O的电离常数Kb=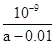 |
铬铁矿主要成分为FeO·Cr2O3,还含有杂质Al2O3。一般铬铁矿中Cr2O3质量分数约为40%。由铬铁矿制备重铬酸钾的方法如下:
已知:
①4FeO·Cr2O3+8Na2CO3+7O2 8Na2CrO4+2 Fe2O3+8CO2↑;
8Na2CrO4+2 Fe2O3+8CO2↑;
②Na2CO3+Al2O3 2NaAlO2+CO2↑;
2NaAlO2+CO2↑;
③ Cr2O72-+H2O  2CrO42-+2H+
2CrO42-+2H+
根据题意回答下列问题:
(1)操作I为 ,固体X中主要含有 (填写化学式);要检测酸化操作中溶液的pH是否等于4.5,应该使用 (填写仪器或试剂名称)。
(2)酸化步骤用醋酸调节溶液pH<5,其目的是 。
(3)操作Ⅲ有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、 、过滤、 、干燥。
(4)固体Y中主要含有氢氧化铝,请写出调节溶液的pH=7~8时生成氢氧化铝的离子方程式 。
常温下,下列有关溶液中微粒的物质的量浓度关系正确的是
| A.pH均为9的①Na2CO3溶液、②CH3COONa溶液、③NaOH溶液,其物质的量浓度的大小顺序为:①>②>③ |
| B.向饱和氯水中加入NaOH溶液至pH=7,所得溶液中:c(Na+)>c(ClO-)>c(Cl-)>c(OH-) |
| C.0.1 mol·L-1 KHC2O4溶液中:c(OH-)=c(H+) +c(H2C2O4)-2c(C2O42-) |
| D.等物质的量浓度Na2CO3溶液和NaHCO3溶液等体积混合,所得溶液中:c(CO32-)+c(OH-)< c(H+)+c(HCO3-)+3c(H2CO3) |
常温下,0.1mol/L氨水溶液中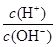 =1×10-8,下列叙述不正确的是
=1×10-8,下列叙述不正确的是
| A.该溶液中氢离子的浓度:c(H+)=1×10-11mol/L |
| B.0.1mol/L氨水溶液与0.1mol/L HCl溶液等体积混合后所得溶液中:c(NH+4)+c(H+)=c(Cl—)+c(OH+) |
| C.0.1mol/L的氨水溶液与0.05mol/L H2SO4溶液等体积混合后所得溶液中:c(NH+4)+c(NH3)+c(NH3·H2O)=2c(SO2—4) |
| D.浓度均为0.1mol/L的NH3·H2O和NH4Cl溶液等体积混合后,若溶液呈碱性,则c(NH4+)>c(NH3·H2O)>c(Cl-)>c(OH-)>c(H+) |
硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得:Na2SO3 + S  Na2S2O3,常温下溶液中析出晶体为Na2S2O3·5H2O。Na2S2O3·5H2O于40~45℃熔化,48℃分解;Na2S2O3易溶于水,不溶于乙醇。在水中有关物质的溶解度曲线如右图所示。
Na2S2O3,常温下溶液中析出晶体为Na2S2O3·5H2O。Na2S2O3·5H2O于40~45℃熔化,48℃分解;Na2S2O3易溶于水,不溶于乙醇。在水中有关物质的溶解度曲线如右图所示。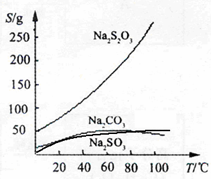
Ⅰ.现按如下方法制备Na2S2O3·5H2O:
将硫化钠和碳酸钠按反应要求比例一并放入三颈烧瓶中,注入150mL蒸馏水使其溶解,在分液漏斗中,注入浓盐酸,在装置2中加入亚硫酸钠固体,并按下图安装好装置。
(1)仪器2的名称为 ,
装置6中可放入 。
| A.BaCl2溶液 | B.浓H2SO4 | C.酸性KMnO4溶液 | D.NaOH溶液 |
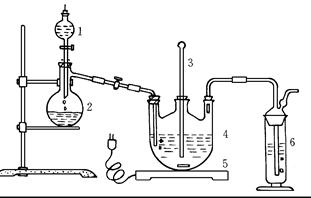
(2)打开分液漏斗活塞,注入浓盐酸使反应产生的二氧化硫气体较均匀的通入Na2S和Na2CO3的混合溶液中,并用磁力搅拌器搅动并加热,反应原理为:
①Na2CO3+SO2 =Na2SO3+CO2
②Na2S+SO2+H2O=Na2SO3+H2S
③2H2S+SO2=3S↓+2H2O
④Na2SO3+S Na2S2O3
Na2S2O3
总反应为:2Na2S+Na2CO3+4SO2= 3Na2S2O3+CO2
随着二氧化硫气体的通入,看到溶液中有大量浅黄色固体析出,继续通二氧化硫气体,反应约半小时。当溶液中pH接近或不小于7时,即可停止通气和加热。溶液PH要控制不小于7理由是
(用离子方程式表示)。
Ⅱ.分离Na2S2O3·5H2O并标定溶液的浓度: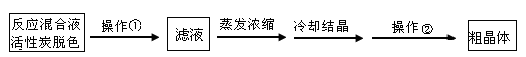
(1)为减少产品的损失,操作①为 ,操作②是抽滤洗涤干燥,其中洗涤操作是用
(填试剂)作洗涤剂。
(2)蒸发浓缩滤液直至溶液呈微黄色浑浊为止,蒸发时为什么要控制温度不宜过高
(3)称取一定质量的产品配置成硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:用分析天平准
确称取基准物质K2Cr2O7(摩尔质量294g/mol)0.5880克。平均分成3份分别放入3个锥形瓶中,加
水配成溶液,并加入过量的KI并酸化,发生下列反应:6I-+Cr2O72-+14H+=3I2+2Cr3++7H2O,再加入几滴
淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应:I2+2S2O32-=2I-+S4O62-,滴定终点的现象为
三次消耗Na2S2O3溶液的平均体积为20.00mL,则所标定的硫代硫酸钠溶液
的浓度为 mol/L。
某芳香烃A是一种重要的有机化工原料,以它为初始原料经过如下转化关系(部分产物、合成路线、反应条件略去)可以合成阿司匹林、扁桃酸等物质。其中D能与银氨溶液发生银镜反应,H是一种功能高分子,其链节组成为C7H5NO。
已知:

(1)写出结构简式:B ;扁桃酸 。
(2)反应②的反应类型为: 。发生反应③的条件为加入 。
反应步骤③与④不能对换,其理由是 。
(3)写出D与银氨溶液反应的化学方程式: 。
(4)写出反应⑤的化学方程式: 。
(5)写出符合下列条件G的三种同分异构体的结构简式 、 、 :
①含有苯环,且苯环上的一氯取代产物只有二种;
②苯环上只有两个取代基,且N原子直接与苯环相连;
③结构中不含醇羟基和酚羟基。
下列判断正确的是
A.同温下,HF比HClO易电离,则NaF溶液的pH比NaClO溶液的pH大
B.常温下,0.4 mol•L-1 HA溶液和0.2 mol•L-1NaOH溶液等体积混合后的pH等于3,则混合溶液中粒子浓度大小关系:c(A-)>c(Na+)>c(HA)>c(H+)>c(OH—)
C.常温下,BaSO4在饱和Na2SO4溶液中的Ksp比在纯水中的Ksp小
D.用铂电极电解食盐水,一段时间后两极产生气体体积比为3:2(同条件下),为将电解液恢复原状,则只需向电解液中通入一定量的HCl气体
以甲醇为替代燃料是解决我国石油资源短缺的重要措施。
(1)CO、CO2可用于甲醇的合成,其相关反应的热化学方程式如下:
CO(g)+2H2(g)=CH3OH(g) △H=" -102.5" kJ·mol-1
CO(g)+H2O(g) = CO2(g)+H2(g) △H="-42.9" kJ·mol-1
则反应CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H= kJ·mol-1
反应CO(g)+H2O(g) = CO2(g)+H2(g)的平衡常数K的表达式为 。
(2)用CO2合成甲醇时可选用亚铬酸锌(ZnCr2O4)或CuCl为催化剂。
①工业制备亚铬酸锌是用CO还原ZnCrO4·H2O,同时生成ZnO。该反应的化学方程式是 。以亚铬酸锌为催化剂时,工业上的适宜温度是:350℃~420℃,可能的原因是 。
② CuCl是不溶于水的白色固体,制备时向CuCl2溶液中加入过量铜粉,发生反应CuCl2+Cu=2CuC1。在实验过程中应先加入浓盐酸,发生反应CuCl + HCl H[CuCl2]。反应结束后将溶液倒入蒸馏水中有CuCl生成。实验过程中加入浓盐酸的目的是 。当c(Cl-)=2×10-3 mol·L—1时, c(Cu+-)= mol·L—1。已知:Ksp(CuCl)=1.7×10-7
H[CuCl2]。反应结束后将溶液倒入蒸馏水中有CuCl生成。实验过程中加入浓盐酸的目的是 。当c(Cl-)=2×10-3 mol·L—1时, c(Cu+-)= mol·L—1。已知:Ksp(CuCl)=1.7×10-7
(3)直接甲醇燃料电池结构如图所示,则负极反应是 。
直接氧化法制备混凝剂聚合硫酸铁[Fe2(OH) n (SO4) 3-n/2]m (n>2 , m≤10)的实验流程如下:
已知:盐基度=n(OH-)/3n(Fe)×100% 。式中n(OH-)、n(Fe)分别表示PFS中OH-和Fe3+的物质的量。所得产品若要用于饮用水处理,需达到盐基度指标为 8.0%~16.0%。
(1)实验加入硫酸的作用是 。取样分析Fe2+浓度,其目的是 。
(2)用pH试纸测定溶液pH的操作方法为 。若溶液的pH偏小,将导致聚合硫酸铁中铁的质量分数 。(填“偏高”、“偏低”、“无影响”)
(3)氧化时控制反应温度为50~60℃的原因是 。
(4)聚合反应的原理为m[Fe2(OH)n(SO4) 3-n/2]  [Fe2(OH)n(SO4) 3-n/2 ] m,则水解反应的化学方程式为 。
[Fe2(OH)n(SO4) 3-n/2 ] m,则水解反应的化学方程式为 。
(5)产品盐基度的测定方法:
Ⅰ 称取m g固体试样,置于400 mL聚乙烯烧杯中,加入25 mL盐酸标准溶液,再加20 mL煮沸后冷却的蒸馏水,摇匀,盖上表面皿。
Ⅱ 室温下放置10 min,再加入10 mL氟化钾溶液,摇匀,掩蔽Fe3+,形成白色沉淀。
Ⅲ 加入5滴酚酞指示剂,立即用物质的量浓度为c mol·L-1的氢氧化钠标准液滴定至终点,消耗体积为V ml。
Ⅳ 向聚乙烯烧杯中,加入25 mL盐酸标准溶液,再加20 mL煮沸后冷却的蒸馏水,摇匀,盖上表面皿。然后重复Ⅱ、Ⅲ做空白试验,消耗氢氧化钠标准液的体积为V0 ml。
①达到滴定终点的现象为 。
②已知试样中Fe3+的质量分数为w1,则该试样的盐基度(w)的计算表达式为 。
对于常温下0.1mol·L-1 NaHCO3溶液,下列叙述不正确的是( )
| A.c (Na+)="c" (HCO3-) + c (CO32-) + c (H2CO3) |
| B.温度升高,溶液的pH升高,但溶液中的c(H+)与c(OH-)乘积不变 |
| C.与等体积等浓度的CH3COOH溶液反应后,溶液中c(Na+)>c(CH3COO-) |
| D.加入适量的NaOH固体,溶液的pH减小 |
下列各溶液中,微粒的物质的量浓度关系错误的是
| A.0.1 mol·L-1 NH4Cl溶液:c(NH4+)<c( Cl-) |
| B.0.1 mol·L-1 Na2CO3溶液:c(Na+)=2c(HCO3-)+2c(CO32¯)+2c(H2CO3) |
| C.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液: c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| D.常温下,将醋酸钠、盐酸两溶液混合呈中性的溶液中:c(Na+)>c( Cl-)=c(CH3COOH) |
常温下,关于下列各溶液的叙述正确的是
| A.pH=7的醋酸钠和醋酸的混合溶液中:c(CH3COO-)>c(Na+) |
| B.0.1mol/L稀醋酸pH=a,0.01mol/L的稀醋酸pH=b,则a+1=b |
| C.0.1mol/L的醋酸钠溶液20mL与0.1mol/L的盐酸10mL混合后溶液显酸性:c(CH3COOH)-c(CH3COO-)=2[c(OH-)-c(H+)] |
| D.已知酸性HF>CH3COOH,pH相等的NaF溶液与CH3COOK溶液中:[c(Na+)-c(F-)] >[c(K+)-c(CH3COO-)] |
工业上可用黄铜矿(CuFeS2)冶炼铜,同时还可得到多种物质。
工业冶炼铜的化学方程式是:
(1)CuFeS2中Fe的化合价为+2,反应中被还原的元素是氧元素和____________。
(2)用少量黄铜矿冶炼铜产生的炉渣(主要含Fe2O3、FeO、SiO2、Al2O3)模拟制铁红(Fe2O3),进行如下实验。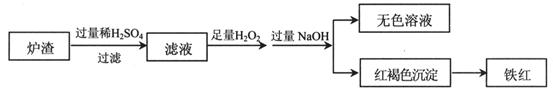
①滤液中的阳离子有Fe3+、Fe2+、H+、_____________。
②为确认滤液中含Fe2+,下列实验方案和预期现象正确的是____(填序号)。
| |
实验方案 |
预期现象 |
| a |
加NaOH溶液 |
产生白色沉淀,变灰绿再变红褐 |
| b |
先加KSCN溶液,再加氯水 |
先无明显现象,后变红 |
| C |
加酸性KMnO4溶液 |
紫色褪去 |
| d |
先加氯水,再加KSCN溶液 |
溶液先变黄,再变红 |
③滤液在酸性条件下,与H2O2反应的离子方程式是
______________________________________________________________________。
(3)冶炼铜过程中产生大量的SO2可用于制硫酸,尾气可用纯碱溶液吸收。已知用1L1mol/L的纯碱溶液吸收SO2,生成n(Na2SO3):n(NaHSO3)=1:2,则吸收的SO2物质的量是_____________mol。
下列溶液中有关物质的量浓度关系正确的是( )
A.pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+) + c(M+) ="=" c(OH-) + c(A-)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3)
C.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:
c(Na+)>c(CH3COO-)>c(H+) >c(OH-)
D.0.1mol·L-1的NaHA溶液,其pH=4: c(H2A)>c(A2-)
试题篮
()