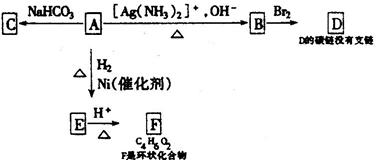
根据图示填空:
(1)化合物A含有的官能团是 。
(2)1mol A与2 mol H2反应生成1mol E,其反应方程式是 。
(3)与A具有相同官能团的A的同分异构体的结构简式是 。
(4)B在酸性条件下与Br2反应得到D,D的结构简式是 。
(5)F的结构简式是 。由E生成F的反应类型是 。
在一定条件下,可逆反应:mA+nB pC达到平衡,若:
pC达到平衡,若:
(1)A、B、C都是气体,减少压强,平衡向正反应方向移动,则m+n和p的关系是 。
(2)A、C是气体,增加B的量,平衡不移动,则B为 态。
(3)A、C是气体,而且m+n=p,增大压强可使平衡发生移动,则平衡移动的方向是 。
(4)加热后,可使C的质量增加,则正反应是 反应(放热或吸热)
现有常温下的六份溶液:①0.01mol/LCH3COOH溶液;②0.01mol/LHCl溶液;③pH=12的氨水;④pH=12的NaOH溶液;⑤0.01mol/LCH3COOH溶液与pH=12的氨水等体积混合后所得溶液;⑥0.01mol/LHCl溶液与pH=12的NaOH溶液等体积混合所得溶液。
⑴其中水的电离程度最大的是 (选填序号,下同),水的电离程度相同的是 ;
⑵若将②、③混合后所得溶液pH=7,则消耗溶液的体积:② ③(选填“>”、“<”或“=”);
⑶将六份溶液稀释相同倍数后,溶液的pH:① ②,③ ④,⑤ ⑥(选填“>”、“<”或“=”);
⑷将①、④混合,若有c(CH3COO-)>c(H+),则混合液可能呈 (填序号)
A.酸性 B.碱性 C.中性
向200mL 6mol·L-1盐酸中加入一定量的纯净CaCO3,产生气体的体积随时间的变化曲线如图所示(气体体积均在标准状况下测定)。
请回答下列问题:
(1)设OE段的反应速率为 1,EF段的反应速率为
1,EF段的反应速率为 2,FG段的反应速率为
2,FG段的反应速率为 3,则
3,则 1、
1、 2、
2、 3从大到小的顺序为 。
3从大到小的顺序为 。
(2)为了减缓上述反应的速率,欲向该溶液中加入下列物质,你认为可行的是 (填字母)。
| A.蒸馏水 | B.氯化钾固体 |
| C.氯化钠溶液 | D.浓盐酸 |
(3)加入CaCO3的质量为 。
(4)若反应过程中溶液体积的变化忽略不计,则EF段用盐酸表示的化学反应速率 (HCl)= 。
(HCl)= 。
相对分子质量不超过200的某芳香族化合物,欲确定其结构,学习小组的同学进行了一系列实验,获得如下信息:
I.元素分析证明:该物质只含C、H、O三种元素,且氧元素的质量分数为31.6%。
II.该物质不能与FeCl3溶液发生显色反应,其苯环上的一元取代物有两种。
III.0.1mol该有机物分别与足量NaHCO3溶液或足量金属钠反应,均可放出2.24L气体(体积均已折算为标准状况下的体积)。
(1)该有机物的结构简式是 。
(2)写出同时符合以下条件的该有机物的两种同分异构体的结构简式: 。
。
(①苯的对位二元取代物 ②能够发生银镜反应 ③遇FeCl3溶液发生显色反应)
(3)第(2)小题中有一种物质还能发生水解反应,写出该物质发生下列反应的方程式
①与Na2CO3溶液反应:
②与NaOH溶液反应:
钢铁工业是国家工业的基础。请回答钢铁冶炼、腐蚀、防护过程的有关问题。
(1)工业用热还原法炼铁,写出由CO还原赤铁矿(主要成分为Fe2O3)的化学方程式:
_________________________ 。
(2)生产中可用盐酸来除铁锈。现将一生锈的铁片放入盐酸中,当铁锈被除尽后,溶液中发生的化合反应的化学方程式______________________。
(3)下列哪些装置可防止铁棒被腐蚀_____________ 。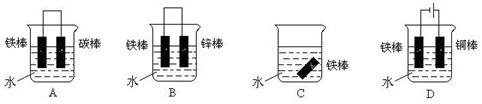
(4)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如下: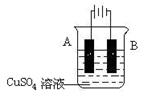
请回答:
① A电极对应的金属是 (写元素名称),B电极的电极反应式是 。
②镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因: 。
(每空1分,共20分)A、B、C、D是四种短周期元素,E是过渡元素。A、B、C同周期,C、D同主族,A的原子结构示意图为:,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
(1)写出下列元素的符号:A _________ B__________ C __________ D __________
(2)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是__________,碱性最强的是_________。
(3)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是__________,电负性最大的元素是__________。
(4)D的氢化物比C的氢化物的沸点__________(填"高"或"低"),原因_____________
(5)E元素原子的核电荷数是__________,E元素在周期表的第_______周期,第________族,已知元素周期表可按电子排布分为s区、p区等,则E元素在_______区。
(6)A、B、C最高价氧化物的晶体类型是分别是______晶体、______晶体、_____晶体。
(7)画出D的核外电子排布图_____________________,这样排布遵循了_______规则。
(8)用电子式表示B的硫化物的形成过程:______________________________________
每空2分,共10分)
根据下列五种元素的电离能数据(单位:kJ/mol),回答下面各题。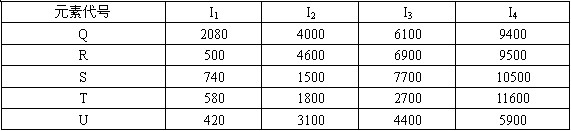
(1)在周期表中,最可能处于同一族的是( )
A.Q和R B.S和T C.T和U D.R和T E.R和U
(2)电解它们的熔融氯化物或氧化物,阴极电极反应式最可能正确的是( )
A.Q2++2e-→Q B.R2++2e-→R C.S3++3e-→S
D.T3++3e-→T E.U2++2e-→U
(3)它们的氯化物的化学式,最可能正确的是( )
A.QCl2 B.RCl C.SCl3 D.TCl E.UCl4
(4)S元素最可能是( )
A.S区元素 B.稀有气体元素 C.p区元素 D.准金属 E.d区元素
(5)下列元素中,化学性质和物理性质最像Q元素的是( )
A.硼(1s22s22p1) B.铍(1s22s2) C.锂(1s22s1)D.氢(1s1)E 氦(1s2)
已知水在25℃和95℃时,其电离平衡曲线如右图所示: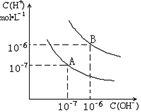
(1)25时,将=9的NaOH溶液与=4的溶液混合,混合所得溶液的=7,则NaOH溶液与溶液的体积比为
(2)95时,若100体积1=的某强酸溶液与1体积2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的1与强碱的2之间应满足的关系是
(3)95时,pH=2的某HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5 ,则HA是 (填“强酸”或“弱酸”)
金属钙线是炼制优质钢材的脱氧脱磷剂,某钙线的主要成分为金属和
,并含有3.5%(质量分数)
。
(1)元素在周期表中位置是,其原子结构示意图;
(2)与最活跃的非金属元素
形成化合物
,
的电子式为;
(3)配平用钙线氧脱鳞的化学方程式:

;
(4)将钙线试样溶于稀盐酸,加入过量溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色
,则检测
的方法是(用离子方程式表达);
(5)取1.6钙线试样,与水充分反映,生成224
(标准状况),在向溶液中通入适量的
,最多能得到
。
已知元素X、Y、Z、W的原子序数分别为6、8、11,请回答:
(1)它们各是什么元素?
(2)不看周期表,你如何来推断它们在周期表中的位置(周期和族)?
(共10分) W、X、Y、Z为短周期内除稀有气体外的4种元素,它们的原子序数依次增大,其中只有Y为金属元素。Y和W的最外层电子数相等。Y、Z两元素原子的质子数之和为W、X两元素质子数之和的3倍。由此可知:
(1)写出元素名称:W_________,X________,Y________,Z_________;Z在元素周期表中的位置_______ __。
(2)Y2Z的电子式为_______ __;W2X2的结构式__________。
(3)两种均含四种元素的化合物相互反应放出气体的化学方程式是 _______
A、B、C、D、E、F是六种短周期主族元素,它们的原子序数依次增大,其中C、F分别是同一主族元素,A、F两种元素的原子核中质子数之和比C、D两种元素原子核中质子数之和少2,F元素的最外层电子数是次外层电子数的0.75倍。又知B元素的最外层电子数是内层电子数的2倍,E元素的最外层电子数等于其电子层数。请回答:
(1)1 mol由E、F二种元素组成的化合物跟由A、C、D三种元素组成的化合物反应生成两种盐和水,完全反应后消耗后者的物质的量为 。
(2)A、C、F间可以形成甲、乙两种负一价双原子阴离子,甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为 ;
(3)科学研究证明:化学反应热只与始终态有关,与过程无关。单质B的燃烧热为a kJ/mol。由B、C二种元素组成的化合物BC 14g完全燃烧放出热量b kJ,写出单质B和单质C反应生成BC的热化学方程式: ;
(4)工业上在高温的条件下,可以用A2C与BC反应制取单质A2。在等体积的I、II两个密闭容器中分别充入1 molA2C和1mol BC、2 mol A2C和2 mol BC。一定条件下,充分反应后分别达到平衡(两容器温度相等)。下列说法正确的是。
A.达到平衡所需要的时间:I>II B.达到平衡后A2C的转化率:I=II
C.达到平衡后BC的物质的量:I>II D.达到平衡后A2的体积分数:I<II
(5)用B元素的单质与E元素的单质可以制成电极浸入由A、C、D三种元素组成化合物的溶液中构成电池,则电池负极反应式为 。
(4分)根据下列叙述写出相应的热化学方程式:
(1)已知16 g固体硫完全燃烧时放出148.4 kJ的热量,该反应燃烧的热化学方程式是
____________________________________________________
(2)如图是298 K时N2与H2反应过程中能量变化的曲线图。该反应的热化学方程式为:_________________________________。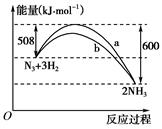
现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题.
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2 =" 1451" kJ/mol I3 = 7733kJ/mol I4 = 10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
⑴已知BA5 为离子化合物,写出其电子式 .
⑵B基态原子中能量最高的电子,其电子云在空间有 个方向,原子轨道呈 形
⑶某同学根据上述信息,推断C基态原子的核外电子排布为: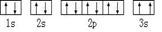
该同学所画的电子排布图违背了 .
⑷G位于 族 区,价电子排布式为 .
⑸DE3 中心原子的杂化方式为 ,用价层电子对互斥理论推测其空间构型为 .
⑹检验F元素的方法是 ,请用原子结构的知识解释产生此现象的原因是 .
⑺若某单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。则晶胞中该原子的配位数为 ,该单质晶体中原子的堆积方式为四种基本模式中的 .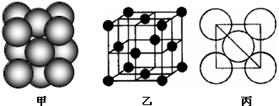
试题篮
()