乳酸(CH3—CHOH—COOH)是人体生理活动的一种代谢产物,其聚合物(聚乳酸)是一种新型可生物降解的高分子材料,主要用于制造可降解纤维、可降解塑料和医用材料。下图是工业上用化学方法对乳酸进行加工处理的过程,其中A、H、G为链状高分子化合物。
物质H的结构简式为 ,回答下列问题:
,回答下列问题:
(1)写出下列物质的结构简式:C ,F 。
(2)上述反应①~⑦中,②是 反应,⑥是 反应。(填反应类型)
(3)写出下列反应的化学方程式:
① 。
⑦ 。
(4)隐形眼镜的制作材料,应具有良好的光学性能、良好的透气性能和亲水性。一般采用G来制作隐形眼镜而不用H,其主要理由是 。
下表是不同温度下水的离子积数据:
| 温度 / ℃ |
25 |
t1 |
t2 |
| 水的离子积常数 |
1×10-14 |
α |
1×10-12 |
试回答下列问题:
(1)若25<t1<t2,则α________1×10-14(填“>”“<”或“=”),作出此判断的理由是________________________________________________________。
(2)已知25℃时饱和NaHCO3溶液的PH>7,则此温度下饱和NaHCO3溶液中各离子浓度关
系正确的是______________
A.c(Na+)>c(HCO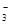 )>c(OH-)>c(H+)>c(CO
)>c(OH-)>c(H+)>c(CO )
)
B.c(Na+)+c(H+)=c(HCO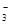 )+c(CO
)+c(CO )+c(OH-)
)+c(OH-)
C.c(Na+)=c(HCO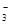 )+c(CO
)+c(CO )+c(H2CO3)
)+c(H2CO3)
D.c(OH-)=c(HCO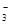 )+c(H2CO3)+c(H+)
)+c(H2CO3)+c(H+)
(3)t2℃下,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2=___________。此溶液中各种离子的浓度由大到小的排列顺序是____________________。
已知可逆反应CO + H2O (g) CO2 + H2,在830K温度下达到平衡。
CO2 + H2,在830K温度下达到平衡。
(1)其化学平衡常数K的表达式为K= 。
(2)830K时,若起始时:c (CO) = 2 mol/L,c (H2O) = 3 mol/L,平衡时CO的转化率为60%,水蒸气的转化率为______________;K值为______________。
(3)830K,若只将起始时c (H2O)改为6 mol/L,则水蒸气的转化率为____________。
(4)若830K时,起始浓度c (CO)=a mol/L,c (H2O)=b mol/L,H2的平衡浓度c (H2)=c mol/L,
①a、b、c之间的关系式是____________________________________;
②当a = b时,a= ________c。
香豆素是用途广泛的香料,合成香豆素的路线如下(其他试剂、产物及反应条件均省略):
(1)Ⅰ的分子式为_____________;
(2)反应②的反应类型是_____________,反应④的反应类型是_____________。
(3)香豆素在过量NaOH溶液中完全水解的化学方程式为_______________________。
(4)Ⅴ是Ⅳ的同分异构体,Ⅴ的分子中含有苯环且无碳碳双键,苯环上含有两个邻位取代基,能发生银镜反应。Ⅴ的结构简式为_______________(任写一种)。
(5)一定条件下, 与CH3CHO能发生类似反应①、②的两步反应,最终生成的有机物的结构简式为_____________。
与CH3CHO能发生类似反应①、②的两步反应,最终生成的有机物的结构简式为_____________。
Ⅰ:某些化学反应可表示为:A+B→C+D+H2O,请回答下列问题:
(1)若A、C、D均含有氯元素,且A中氯元素的化合价介于C与D之间,该反应离子方程式为 。
(2)若A为淡黄色固体,C为无色的气体,则该反应的离子方程式为 。
(3)若A、C、D均是铁的化合物,B是稀硫酸,则A与B反应的化学方程式为 。
Ⅱ:某些化学反应可表示为:A+B+H2O→C+D。请回答下列问题:
(1)若A为非金属单质,C为非金属单质,写出符合要求的化学反应方程式
(2)若A为金属单质,C为非金属单质,写出符合要求的离子方程式_____________________.
(6分)已知A、B、C、D分别是AlCl3、BaCl2、FeSO4、NaOH四种化合物中的一种,它们的水溶液之间的一些反应现象如下:
① A + B→白色沉淀,加入稀硝酸,沉淀不溶解
② B + D→白色沉淀,在空气中放置,沉淀由白色转化为红褐色
③ C + D→白色沉淀,继续加入D溶液,白色沉淀逐渐消失
⑴试推断A B C D (化学式)。
⑵写出下列反应的化学方程式或离子方程式:
①实验②中沉淀由白色转化为红褐色的化学方程式 ,
②C溶液与D溶液反应后生成的白色沉淀溶解于D溶液中的离子方程式 。
氧化铝有两种变体,一种是αAl2O3,一种是γAl2O3,γAl2O3可用Al(OH)3在723 K时加热制得,它不耐酸;αAl2O3是天然刚玉的主要成分,硬度很大,且对酸有极强的稳定性。αAl2O3可以用γAl2O3高温煅烧制得。已知氧化铝可由铝铵矾加热制得,铝铵矾[(NH4)Al(SO4)2·12H2O]受强热分解的产物为:Al2O3、NH3、N2、SO3、SO2和H2O。
(1)写出铝铵矾受强热分解的化学方程式_____________________________________
________________________________________________________________________,
氧化产物是________,还原产物是________,它们的物质的量之比为________。
(2)在含有1 mol的铝铵矾溶液中,需加入________molBa(OH)2,沉淀的物质的量最大,离子方程式为______________________________________________________________
________________________________________________________________________。
(3)将上述反应中的Al2O3加入适量的氧化铬,在氢氧焰上强热,熔融后使其结晶,可以制成人造红宝石,可用于做激光器材和装饰品。所得人造红宝石是哪种Al2O3的变体?________,如何用简单方法证明是该变体______________________________________
________________________________________________________________________。
某新型无机非金属材料A,由两种非金属元素组成,其中所含元素的化合价为其最高正价或最低负价,它是一种超硬物质,具有耐磨、耐腐蚀、抗冷热冲击、抗氧化的特征。A可由化合物B经下列反应制得:①B+NH3―→C[C的化学式为Si(NH2)4];②C经隔绝空气高温分解得到A。为探究B的组成,进行了下图所示的转化实验,图中G、F、H均为难溶于水的物质,且为白色粉末,图中字母代表的均为中学化学常见的物质。
请回答下列问题:
(1)写出化合物B和化合物G的化学式__________、________。
(2)写出反应②的离子方程式: ___________________________________________。
(3)写出C经隔绝空气高温分解得到A的化学方程式:
________________________________________________________________________。
(4)分析反应③,你能得出的结论是________________________________________(合理即可)。
根据下图所示的转化关系填空(假设每一步反应的反应物均恰好反应完)
(1)写出反应①的化学方程式: 。
此反应中,氧化剂与还原剂的个数比为 。当有3.2 g气体产生时,消耗淡黄色固体的物质的量是_______mol,固体增重_______g;
(2)写出反应②、③、④的离子方程式:
②
③
④
二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。与Cl2相比,ClO2不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(ClO2—)。2001年我国卫生部规定,饮用水中ClO2—的含量应不超过0.2mg·L-1。
饮用水中CIO2、CIO2—的含量可用连续碘量法进行测定。CIO2被I—还原为CIO2—、Cl—的转化率与溶液pH的关系如下图所示。当pH≤2.0时,CIO2—也能被I—完全还原成Cl—。反应生成的I2用标准Na2S2O3溶液滴定:
2Na2S2O3+I2==Na2S4O6+2NaI

①请写出pH≤2.0时,CIO2—与I—反应的离子方程式 。
②请完成相应的实验步骤:
步骤1:准确量取V mL水样加入到锥形瓶中。
步骤2:调节水样的pH为7.0~8.0。
步骤3:加入足量的K I晶体。
步骤4:加少量淀粉溶液,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V1mL。
步骤5: 。
步骤6:再用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2mL。
③根⑤据你现有的知识,写出步骤4滴定至终点的现象判断依据为
④根据上述分析数据,测得该饮用水样中CIO2—的浓度为 mol·L-1(用含字母的代数式表示。)
⑤若饮用水中ClO2— 的含量超标,可向其中加入适量的Fe2+将ClO2— 还原成Cl—-, 请猜测该反应的氧化产物是 (填化学式)。
金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝。高温下,在密闭容器中用H2还原WO3可得到金属钨,其总反应为:
WO3(s)+3 H2(g) W(s)+3 H2O(g)
W(s)+3 H2O(g)
请回答下列问题:
(1)上述反应的化学平衡常数表达式为
(2)某温度下反应达平衡时,随温度的升高, H2与水蒸气的体积比减小,则该反应为_____________反应(填 吸热或放热)
(3)上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:
| 温度 |
25 ℃ ~ 550 ℃ ~ 600℃ ~ 700℃ |
| 主要成分 |
WO3 W2O5 WO2 W |
第一阶段反应的化学方程式为___________________________________________;580℃时,固体物质的主要成分为______ _________;,
(4)已知:温度过高时,WO2(s)转变为WO2(g);
WO2(s)+2 H2(g) W(s)+2H2O(g) ΔH=+66 kJ·mol-1
W(s)+2H2O(g) ΔH=+66 kJ·mol-1
WO2(g)+2 H2(g) W(s)+2H2O(g) ΔH= —137.9 kJ·mol-1
W(s)+2H2O(g) ΔH= —137.9 kJ·mol-1
则WO2(s) WO2(g)的ΔH=_____ _______.
WO2(g)的ΔH=_____ _______.
(5)钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:
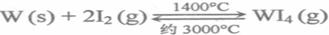
下列说法正确的有____________.
A.灯管内的I2可循环使用
B.WI4在灯丝上分解,产生的W又沉积在灯丝上
C.WI4在灯管壁上分解,使灯管的寿命延长
D.温度升高时, WI4的分解速率加快,W和I2的化合速率减慢
选修四模块的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理。请回答下列问题:
(1) 一定温度下,在一个固定容积的密闭容器中,可逆反应 A(g) +2B(g)  4C (g) △H >0 达到平衡时,c(A) ="2" mol·L-1,c ( B) =" 7" mol·L-1,c ( C) =" 4" mol·L-1。试确定B的起始浓度c (B)的取值范围是 ;若改变条件重新达到平衡后体系中C的质量分数增大,下列措施可行的是 。
4C (g) △H >0 达到平衡时,c(A) ="2" mol·L-1,c ( B) =" 7" mol·L-1,c ( C) =" 4" mol·L-1。试确定B的起始浓度c (B)的取值范围是 ;若改变条件重新达到平衡后体系中C的质量分数增大,下列措施可行的是 。
A. 增加C的物质的量 B. 加压
C. 升温 D.使用催化剂
(2)常温下,取 pH=2的盐酸和醋酸溶液各100mL, 向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如右图所示。则图中表示醋酸溶液中pH变化曲线的是 ( 填“A”或“B”)。 设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为 m2。 则
m1 m2 ( 选填“<”、“=”、“>”)
(3) 在体积为3L的密闭容器中,CO与H2在一定条件下反应生成甲醇:CO ( g) + 2H2( g) → CH3OH(g) ΔH= —91kJ·mol-1。反应达到平衡时,平衡常数表达式K= ,升高温度,K值 (填“增大”、“减小”或“不变”)。
(4) 难溶电解质在水溶液中也存在溶解平衡。在常温下,溶液里各离子浓度以它们化学计量数为方次的乘积是一个常数,叫溶度积常数。例如: Cu(OH)2(s) Cu2+ (aq) + 2OH - ( aq),Ksp =" c" (Cu2+ ) c 2(OH - ) =" 2×10" -20。当溶液中各离子浓度计量数方次的乘积大于溶度积时,则产生沉淀。若某CuSO4溶液里c( Cu2+) ="0.02" mol·L-1,如果生成Cu(OH)2沉淀,应调整溶液pH,使pH大于 ; 要使0.2 mol·L-1的CuSO4溶液中Cu2+沉淀较为完全 ( 使Cu2+浓度降至原来的万分之一)则应向溶液里加NaOH溶液,使溶液pH等于 。
Cu2+ (aq) + 2OH - ( aq),Ksp =" c" (Cu2+ ) c 2(OH - ) =" 2×10" -20。当溶液中各离子浓度计量数方次的乘积大于溶度积时,则产生沉淀。若某CuSO4溶液里c( Cu2+) ="0.02" mol·L-1,如果生成Cu(OH)2沉淀,应调整溶液pH,使pH大于 ; 要使0.2 mol·L-1的CuSO4溶液中Cu2+沉淀较为完全 ( 使Cu2+浓度降至原来的万分之一)则应向溶液里加NaOH溶液,使溶液pH等于 。
(5) 常温下,某纯碱(Na2CO3) 溶液中滴入酚酞,溶液呈红色。则该溶液呈 性。在分析该溶液遇酚酞呈红色原因时,甲同学认为是配制溶液所用的纯碱样品中混有NaOH 所致;乙同学认为是溶液中Na2CO3电离出的CO32-水解所致。请你设计一个简单的实验方案用来评判甲乙两位同学的观点是否正确(包括操作、现象和结论) 。
工业制备铝一般是从铝土矿(主要成分是Al2O3,含有Fe2O3杂质)中得到纯净的是Al2O3,然后电解是Al2O3得到铝。下图是从铝土矿中提纯是Al2O3的简单示意图。其中牵涉到的一个反应是:2NaAlO2+CO2+3H2O=Na2CO3+2Al(OH)3↓。
(1)写出图示中(1)的实验操作是 ;图示中(2)加入的试剂 。
(2)试推断物质(写化学式)B ;C ;H ;F 。
(3)写出化学方程式:
① 。
② 。
③ 。
④ 。
有A、B、C、D、E、F六种元素,已知:它们位于三个不同短周期,核电荷数依次增大;A与E、B与F分别同主族;A与D按原子个数比1﹕1或2﹕l形成常温下为液态的化合物,E也能与D按原子个数比1﹕1或2﹕l形成化合物,B的外围电子数为内层电子数的两倍,B、C分别都能与D按原子个数比1﹕1或1﹕2形成化合物。请按要求回答以下问题:
(1)上图是A与D形成的一种化合物的晶体结构示意图,其中的虚线表示 , E与D按原子个数比1﹕1形成的化合物的电子式为 。
(2)人们通常把拆开l mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。下表列出了上述部分元素形成的化学键的键能:
| 化学键 |
F—D |
F—F |
B—B |
F—B |
C═D |
D═D |
| 键能/kJ·mol-1 |
460 |
176 |
347.7 |
347 |
745 |
497.3 |
①下列三种物质形成的晶体,熔点由高到低的顺序(用a、b、c表示):
a.F与B形成的化合物 b.B与D形成的稳定化合物 c.F的单质
②F单质晶体中一个F原子与其紧邻的F原子形成的空间构型为_____________,
③已知加热下可发生如下转化:
F(s) + D2(g) 加热 FD2(s)
根据上表数据计算F单质晶体发生上述反应的反应热△H为: 。
我国化学家侯德榜(下图所示)改革国外的纯碱生产工艺,生产流程可简要表示如下:

(1)上述生产纯碱的方法称__________________,副产品的一种用途为_______
_ 。
(2)沉淀池中发生的化学反应方程式是_____________ _______。
(3)写出上述流程中X物质的分子式___ _____。
(4)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了___ _(填上述流程中的编号)的循环,从沉淀池中取出沉淀的操作是_____ ___。
(5)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加_______________。
(6)向母液中通氨气,加入细小食盐颗粒,冷却析出副产品。通氨气的作用有______ 。
a.增大NH的浓度,使NH4Cl更多地析出
b.使NaHCO3更多地析出
c.使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
试题篮
()