(1)已知25℃时有关弱酸的电离平衡常数:
| 弱酸化学式 |
HSCN |
CH3COOH |
HCN |
H2CO3 |
| 电离平衡常数 |
1.3×10—1 |
1.8×10—5 |
4.9×10—10 |
K1=4.3×10—7 K2=5.6×10—11 |
①25℃时,将20mL0.1mol/LCH3COOH溶液和20mL0.1mol/LHSCN溶液分别与20mL 0.1mol/LNaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示:

反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是:________________.
反应结束后所得两溶液中,c(SCN—) c(CH3COO—)(填“>”、“<”或“=”)
②若保持温度不变,,下列量会变小的是______________(填序号)
a.c(CH3COO-) b.c(H+) c.Kw d.醋酸电离平衡常数
(2)若往20mL0.1mol/L的弱酸HNO2溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如右图所示,下列有关说法正确的是_______________。

①该烧碱溶液的浓度为0.02mol·L-1
②该烧碱溶液的浓度为0.01mol·L-1
③HNO2的电离平衡常数:b点>a点
④从b点到c点,混合溶液中一直存在:c(Na+)>c(NO2-)>c(OH-)>c(H+)
碳、氮及其化合物在工农业生产生活中有着重要作用。请回答下列问题:
(1)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)ΔH1=-574kJ·molˉ1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2
若2molCH4还原NO2至N2,整个过程中放出的热量为1734kJ,则ΔH2= ;
(2)据报道,科学家在一定条件下利用Fe2O3与甲烷反应可制取“纳米级”的金属铁。其反应为:Fe2O3(s)+3CH4(g) 2Fe(s)+3CO(g)+6H2(g) ΔH>0
2Fe(s)+3CO(g)+6H2(g) ΔH>0
①若反应在5L的密闭容器中进行,1min后达到平衡,测得Fe2O3在反应中质量减少3.2g。则该段时间内CO的平均反应速率为________________。
②若该反应在恒温恒压容器中进行,能表明该反应达到平衡状态的是____________
a.CH4的转化率等于CO的产率
b.混合气体的平均相对分子质量不变
c.v(CO)与v(H2)的比值不变
d.固体的总质量不变
③该反应达到平衡时某物理量随温度变化如图所示,当温度由T1升高到T2时,平衡常数KA KB(填“>”、“<”或“=”)。纵坐标可以表示的物理量有哪些 。

a.H2的逆反应速率
b.CH4的的体积分数
c.混合气体的平均相对分子质量
d.CO的体积分数
(3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解50ml2mol/L的氯化铜溶液的装置示意图:

请回答:
①甲烷燃料电池的负极反应式是:__________________________。
②当A中消耗0.05mol氧气时,B中________________极(填“a”或“b”)增重________________g。
(4)工业合成氨气需要的反应条件非常高且产量低,而一些科学家采用高质子导电性的SCY陶瓷(能传递H+)实现氨的电化学合成,从而大大提高了氮气和氢气的转化率。电化学合成氨过程的总反应式为:N2+3H2 2NH3,该过程中还原反应的方程式为 。
2NH3,该过程中还原反应的方程式为 。
电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,除去浮渣层,即起到了浮选净化的作用。某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示。

(1)实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣。此 时,可向污水中加入适量的 。
a.BaSO4 b.CH3CH2OH c.Na2SO4 d.NaOH
(2)电解池阳极发生了两个电极反应,其中一个反应生成一种无色气体,则阳极的电极反应式分别是
①.______________________;②. 。
(3)电极反应①和②的生成物反应得到Fe(OH)3沉淀的离子方程式是____________________。
(4)该燃料电池是以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,稀土金属材料作电极。为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环(如图)。A物质的化学式是____________________。
(共11分)将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:
NH2COONH4(s) 2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
| 温度(℃) |
15.0 |
20.0 |
25.0 |
30.0 |
35.0 |
| 平衡总压强(kPa) |
5.7 |
8.3 |
12.0 |
17.1 |
24.0 |
| 平衡气体总浓度 |
|
|
|
|
|
| (×10-3 mol·L-1) |
2.4 |
3.4 |
4.8 |
6.8 |
9.4 |
(1)氨基甲酸铵(NH2COONH4)分解反应平衡常数K的表达式为_____ __。
(2)判断氨基甲酸铵分解反应的ΔH____________0(填“>”、“<”或“=”),其原因是什么?
(3)判断氨基甲酸铵分解反应的ΔS____ _0(填“>”、“<”或“=”),该反应在任何温度下是否一定能自发进行?
(4)升高温度,化学平衡常数K如何变化? 增大容器的压强,K值如何变化? (填“变大”“变小”或“不变”)
(5)根据表格中的数据,计算25℃时,氨基甲酸铵的分解平衡常数
(6)将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡,判断该分解反应已经达到化学平衡的是( )
A.2v(NH3)=v(CO2) B.密闭容器中混合气体平均分子量不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
固定和利用CO2,能有效地利用资源,并减少空气中的温室气体.工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的化学方程式是:
CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)+49.0kJ
某科学实验将6mol CO2和8mol H2充入一容积为2L的密闭容器中,测得H2的物质的量随时间变化如图中实线所示(图中字母后的数字表示对应的坐标):

回答下列问题:
(1)由图分析,在下列时间段内反应速率最快的时间段是 (填答案编号)
a.0~1min b.1~3min c.3~8min d.8~11min
(2)该反应在0~8min内CO2的平均反应速率是 mol/(L•min).
(3)仅改变某一条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示.与实线相比,曲线Ⅰ改变的条件可能是 ,曲线Ⅱ改变的条件可能是
若实线对应条件下平衡常数为K,曲线Ⅰ对应条件下平衡常数为K1,曲线Ⅱ对应条件下平衡常数为K2,则K、K1和K2的大小关系是
(4)下列表述能表示该反应已达平衡的是 (填答案编号)
a.容器内压强不再改变 b.容器内气体的密度不再改变
c.容器内气体平均摩尔质量不再改变 d.容器内各物质的物质的量相等
【化学——选修3:物质结构与性质】
(1)按已知的原子结构规律,27号元素在周期表中的位置是 ,其价电子的轨道排布图为 。
(2)若en代表乙二胺(  ),则配合物[Pt(en)2]Cl4中心离子的配位原子数为 。
),则配合物[Pt(en)2]Cl4中心离子的配位原子数为 。
(3)BeCl2是共价分子,可以以单体、二聚体和多聚体形式存在。它们的结构简式如下,指出Be的杂化轨道类型。
①  ②
② 
③ 
(4)磷化硼(BP)是一种有价值的耐磨硬涂层材料,这种陶瓷材料可作为金属表面的保护薄膜。它是通过在高温氢气氛围下(>750℃)三溴化硼和三溴化磷反应制得。BP晶胞如图所示。

①画出三溴化硼和三溴化磷的空间结构式。
三溴化硼
三溴化磷
②在BP晶胞中B的堆积方式为 。
③计算当晶胞晶格参数为478pm(即图中立方体的每条边长为478pm)时磷化硼中硼原子和磷原子之间的最近距离 。
燃煤能排放大量的CO、CO2、SO2,PM2.5(可入肺颗粒物)污染也跟冬季燃煤密切相关。SO2、CO、CO2也是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径。
(1)如图所示,利用电化学原理将SO2转化为重要化工原料C

若A为SO2,B为O2,则负极的电极反应式为:________________________;
(2)有一种用CO2生产甲醇燃料的方法:CO2+3H2 CH3OH+H2O
CH3OH+H2O
已知:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-a kJ·mol-1;
CH3OH(g)+H2O(g)△H=-a kJ·mol-1;
2H2(g)+O2(g)=2H2O(g)△H=-b kJ·mol-1;
H2O(g)=H2O(l)△H=-c kJ·mol-1;
CH3OH(g)=CH3OH(l)△H=-d kJ·mol-1,
则表示CH3OH(l)燃烧热的热化学方程式为:____________________________;
(3)光气 (COCl2)是一种重要的化工原料,用于农药、医药、聚酯类材料的生产,工业上通过Cl2(g)+CO(g)
 COCl2(g)制备。左图为此反应的反应速率随温度变化的曲线,右图为某次模拟实验研究过程中容器内各物质的浓度随时间变化的曲线。回答下列问题:
COCl2(g)制备。左图为此反应的反应速率随温度变化的曲线,右图为某次模拟实验研究过程中容器内各物质的浓度随时间变化的曲线。回答下列问题:
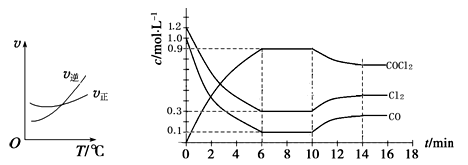
① 0~6 min内,反应的平均速率v(Cl2)= ;
② 若保持温度不变,在第7 min 向体系中加入这三种物质各2 mol,则平衡 移动(填“向正反应方向”、“向逆反应方向”或“不”);
③ 若将初始投料浓度变为c(Cl2)=0.7 mol/L、c(CO)=0.5 mol/L、c(COCl2)= mol/L,保持反 应温度不变,则最终达到化学平衡时,Cl2的体积分数与上述第6 min时Cl2的体积分数相同;
④ 随温度升高,该反应平衡常数变化的趋势是 ;(填“增大”、“减小”或“不变”)
⑤比较第8 min反应温度T(8)与第15 min反应温度T(15)的高低:T(8)______________T(15)(填“<”、“>”或“=”)。
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂。如图是以铁屑为原料制备K2FeO4的工艺流程图:
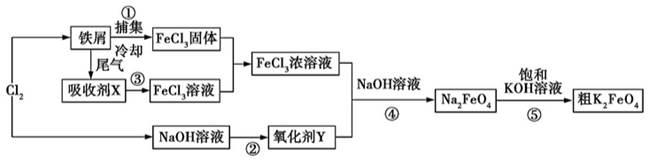
请回答下列问题:
(1)氯气与铁屑反应生成FeCl3的条件是 ,其生成物氯化铁也可作净水剂,其净水原理为 。
(2)流程图中的吸收剂X 为 (选填字母代号)。
a.NaOH 溶液 b.Fe 粉
c.FeSO4溶液 d.FeCl2溶液
(3)氯气与NaOH 溶液反应生成氧化剂Y 的离子方程式为 。
(4)反应④的化学方程式为 ,该反应中氧化剂与还原剂的物质的量之比为 。
(5)K2FeO4的净水原理是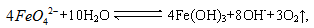 ,该反应生成具有吸附性的Fe(OH)3。用上述方法制备的粗K2FeO4需要提纯,可采用重结晶、洗涤、低温烘干的方法,洗涤剂可选用稀KOH 溶液,原因是 。
,该反应生成具有吸附性的Fe(OH)3。用上述方法制备的粗K2FeO4需要提纯,可采用重结晶、洗涤、低温烘干的方法,洗涤剂可选用稀KOH 溶液,原因是 。
(6)测定制备的粗K2FeO4的纯度可用滴定法,滴定时有关反应的离子方程式为:
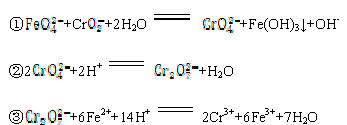
现称取1.98 g 粗K2FeO4样品溶于适量KOH 溶液中,加入稍过量的KCrO2,充分反应后过滤,滤液在250 mL 容量瓶中定容。每次取25.00 mL 加入稀硫酸酸化,用0.100 0 mol·L-1的(NH4)2Fe(SO4)2标准溶液滴定,三次滴定消耗标准溶液的平均体积为18.93 mL。则上述样品中K2FeO4的质量分数为 。
2015年8月12日23:30左右,天津滨海新区的一处集装箱码头发生爆炸,发生爆炸的是集装箱内的易燃易爆物品氰化钠,数量为700吨左右。
资料:氰化钠化学式为NaCN,白色结晶颗粒或粉末,易潮解,有微弱的苦杏仁气味。剧毒,皮肤伤口接触、吸入、吞食微量可中毒死亡。熔点563.7℃,沸点1496℃。易溶于水,易水解生成氰化氢,水溶液呈强碱性,是一种重要的化工原料, 用于电镀、冶金和有机合成医药、农药及金属处理方面。
(1)用离子方程式表示其水溶液呈强碱性的原因:
(2)氰化钠要用双氧水或硫代硫酸钠中和。①用双氧水处理产生一种酸式盐和一种能使湿润的红色石蕊试纸变蓝的气体,请写出该反应的化学方程式 ;
②用硫代硫酸钠中和的离子方程式为CN-+S2O32-===A+SO32-,A为 (填化学式)。
(3)含氰废水中的CN-有剧毒。
①CN-中C元素显+2价, N元素显-3价,则非金属性N C(填<,=或>)
②在微生物的作用下,CN-能够被氧气氧化成HCO3-,同时生成NH3,该反应的离子方程式为 。
③用如图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液PH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是

A.用石墨作阳极,铁作阴极
B.阳极的电极反应式为:Cl- + 2OH--2e-= ClO- + H2O
C.阴极的电极反应式为:2H2O + 2e- = H2↑ + 2OH-
D.除去CN-的反应:2CN-+ 5ClO- + 2H+ ===N2↑ + 2CO2↑ + 5Cl-+H2O
(4)过碳酸钠(2Na2CO3·3H2O2)是一种集洗涤、漂白、杀菌于一体的氧系漂白剂,也可用于含氰废水的消毒。某兴趣小组制备过碳酸钠的实验方案和装置示意图如下:

已知:2Na2CO3(aq)+ 3H2O2(aq) 2Na2CO3·3H2O2(s)ΔH < 0,请回答下列问题:
2Na2CO3·3H2O2(s)ΔH < 0,请回答下列问题:
①下列物质中,不会引起过碳酸钠发生氧化还原反应的有 。
A.FeCl3 B.CuSO4C.Na2SiO3 D.KCN
②准确称取0.2000g过碳酸钠于250mL锥形瓶中,加50 mL蒸馏水溶解,再加50 mL2.0 mol·L-1 H2SO4,用0.02000mol·L-1 KMnO4标准溶液滴定至终点时消耗30.00 mL,则产品中H2O2的质量分数为 。
[反应6KMnO4 + 5(2Na2CO3·3H2O2)+19H2SO4 = 3K2SO4 + 6MnSO4 +10Na2SO4 +10CO2 ↑ +15O2↑+34H2O]
钛冶炼厂与氯碱厂、甲醇厂组成一个产业链(如图所示),将大大提高资源的利用率,减少环境污染。
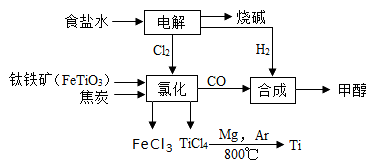
请回答下列问题:
(1)Fe位于元素周期表中第________________周期,第_______________族。
(2)写出钛铁矿在高温下与焦炭经氯化得到四氯化钛的化学方程式 。
(3)制备TiO2的方法之一是利用TiCl4水解生成TiO2·x H2O,再经焙烧制得。水解时需加入大量的水并加热,请结合化学方程式和必要的文字说明原因:
(4)反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于 ℃即可。
| |
TiCl4 |
Mg |
MgCl2 |
Ti |
| 熔点/℃ |
-25.0 |
648.8 |
714 |
1667 |
| 沸点/℃ |
136.4 |
1090 |
1412 |
3287 |
(5)用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。滴定分析时,称取TiO2(摩尔质量为M g/mol)试样w g,消耗c mol/L NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数为___________________。(用代数式表示)
(6)由CO和H2合成甲醇的方程式是:CO(g)+2H2(g) CH3OH(g)。若不考虑生产过程中物质的任何损失,上述产业链中每合成6mol甲醇,至少需额外补充H2 mol。
CH3OH(g)。若不考虑生产过程中物质的任何损失,上述产业链中每合成6mol甲醇,至少需额外补充H2 mol。
某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5um的悬浮颗粒物)其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。
请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 |
K+ |
Na+ |
NH4+ |
SO42- |
NO3- |
Cl- |
| 浓度/mol·L-1 |
4×10-6 |
6×10-6 |
2×10-5 |
4×10-5 |
3×10-5 |
2×10-5 |
根据表中数据判断试样的pH约为 。
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。已知:
2H2(g)+O2(g)=2H2O(g)K1
2C(s)+O2(g)=2CO(g)K2
C(s)+ H2O(g)=CO(g)+ H2(g)K=____ ___(用含K1、K2的式子表示)。
②洗涤含SO2的烟气。以下物质可作洗涤剂的是 。
A.Ca(OH)2 B.Na2CO3 C.CaCl2 D.NaHSO3
(3)汽车尾气中有NOx和CO的生成及转化为
①已知气缸中生成NO的反应为:N2 (g)+O2(g)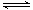 2NO(g)△H
2NO(g)△H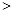 0
0
若1mol空气含0.8molN2和0.2molO2,1300℃时在密闭容器内反应达到平衡,测得NO为8×10-4mol。计算该温度下的平衡常数K= 。
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO,2CO(g)=2C(s)+O2(g)。已知该反应的△H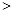 0,简述该设想能否实现的依据 。
0,简述该设想能否实现的依据 。
③目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为 。
(1)已知常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②H2O(l)=H2O(g)△H=+44.0kJ/mol
写出甲醇燃烧的热化学方程式________________________。
(2)甲醇是一种重要的化工原料,又是一种可再生能源,具有开发和应用的广阔前景。工业上用如下方法好处甲醇:

①方法一:该反应的△S__ ___0(填“>”或“<”)。图中曲线a到曲线b的措施是____ _____,恒温恒容时,下列说法能说明反应到达平衡状态的是___ _____。
| A.体系的平均摩尔质量不再改变 | B.V(CO)=V(CH3OH) |
| C.H2的转化率达到了最大限度 | D.△H不再改变 |
②方法二:将CO2和H2按物质的量之比1:3充入体积为2.0L的恒容密闭容器中反应,如图两条曲线分别表示压强为0.1MPa和5.0MPa下CO2转化率随温度的变化关系,其中a点的平衡常数表达式为:___________;a,b两点化学反应速率别用Va、Vb表示,则Va__ ___Vb(填“大于”、“小于”或“等于”)。已知原子利用率=期望产物的总质量与生成物的总质量之比,则方法二的原子利用率与方法一的原子利用率之比为__ _。
(3)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是通电后将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。写出除去甲醇的离子方程式____ _____。
如图所示,一密闭容器被无摩擦、可滑动的两隔板a、b分成甲、乙两室;标准状况下,在乙室中充入0.6mol HCl,甲室中充入NH3、H2的混合气体,静止时活塞位置如下图。已知甲、乙两室中气体的质量之差为10.9g。
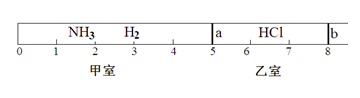
(1)甲室中气体的物质的量为 。
(2)甲室中气体的质量为 。
(3)甲室中NH3,H2的物质的量之比为 。
(4)将隔板a去掉,发生下列反应:HCl(g)+NH3(g)=NH4Cl(s),当HCl与NH3充分反应后,活塞b将位于刻度“ ”处(填数字)。
工业上合成氨的反应:N2(g)+3H2(g) 2NH3(g)ΔH=-92.60 kJ·mol-1。
2NH3(g)ΔH=-92.60 kJ·mol-1。
(1)在绝热、容积固定的密闭容器中发生反应:N2(g)+3H2(g) 2NH3(g),下列说法能说明上述反应向正反应方向进行的是____________________(填序号)。
2NH3(g),下列说法能说明上述反应向正反应方向进行的是____________________(填序号)。
①单位时间内生成2n mol NH3的同时生成3n mol H2
②单位时间内生成6n mol N—H键的同时生成2n mol H—H键
③用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1∶3∶2
④混合气体的平均摩尔质量增大
⑤容器内的气体密度不变
(2)已知合成氨反应在某温度下2 L的密闭容器中进行,测得如下数据: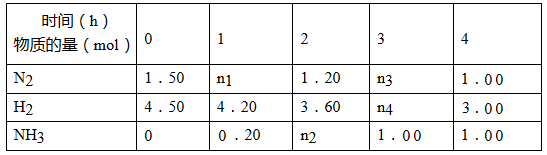
根据表中数据计算:
①反应进行到2 h时放出的热量为_________________kJ。
②此温度下该反应的化学平衡常数K=_________________(保留两位小数)。
③反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00 mol,化学平衡将向________________方向移动(填“正反应”或“逆反应”或“不移动”)。
④有甲、乙两个完全相同的容器,向甲容器中加入1 mol N2(g)和6mol H2(g),在一定条件下达到平衡时的热效应(吸热或放热)为Q,在相同条件下向乙容器中加入2 mol NH3(g)和3mol H2(g),达到平衡时的热效应(放热或吸热)为4Q。则甲容器中H2的转化率为________________。
[化学-选修5:有机化学基础]
有机物A为烃类化合物,质谱图表明其相对分子质量为70,其相关反应如下图所示,其中B、D、E的结构中均含有2个—CH3,且它们的核磁共振氢谱中均出现4个峰。

请回答:
(1)B中所含官能团的名称为 ; D的分子式为 ;
(2)Ⅲ的反应类型为 (填字母序号);
a.还原反应 b.加成反应 c.氧化反应 d.消去反应
(3)写出下列反应的化学方程式:
a.反应Ⅰ: ;
b.A在催化剂条件下,反应生成高聚物: ;
(4)A分子中最多有 个原子共平面,A的同分异构体中有一对互为顺反异构的链状有机物,且结构中含有2个—CH3,它们的结构简式为 和 ;
(5)E的一种同分异构体能发生银镜反应,能与足量金属钠生成氢气,不能发生消去反应,其结构简式为 。
试题篮
()