海水中蕴藏着丰富的资源。海水综合利用的流程图如下。

(1)用NaCl做原料可以得到多种产品。
①工业上由NaCl制备金属钠的化学方程式是
②实验室用惰性电极电解100 mL0.1 mol/LNaCl溶液,若阴阳两极均得到112 mL气体(标准状况),则所得溶液的pH为__________(忽略反应前后溶液的体积变化)。
③电解氯化钠稀溶液可制备“84消毒液”,通电时氯气被溶液完全吸收,若所得消毒液仅含一种溶质,写出相应的化学方程式: 。
(2)分离出粗盐后的卤水中蕴含着丰富的镁资源,经过下列途径可获得金属镁:

卤水 Mg(OH)2
Mg(OH)2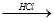 MgCl2溶液→MgCl2·6H2O→MgCl2
MgCl2溶液→MgCl2·6H2O→MgCl2 Mg
Mg
其中,由MgCl2·6H2O制取无水MgCl2的部分装置(铁架台、酒精灯已略)如下:
①上图中,装置a由 、 、双孔塞和导管组成
②循环物质甲的名称是
③制取无水氯化镁必须在氯化氢存在的条件下进行,原因是
④装置b中填充的物质可能是
、碳和氮的化合物与人类生产、生活密切相关。

(1)在一恒温、恒容密闭容器中发生反应:Ni (s)+4CO(g) Ni(CO)4(g),ΔH<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。下列说法正确的是 (填字母编号)。
Ni(CO)4(g),ΔH<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。下列说法正确的是 (填字母编号)。
| A.增加Ni的量可提高CO的转化率,Ni的转化率降低 |
| B.缩小容器容积,平衡右移,ΔH减小 |
| C.反应达到平衡后,充入CO再次达到平衡时, CO的体积分数降低 |
| D.当4v正[Ni(CO)4]= v正(CO)时或容器中混合气体密度不变时,都可说明反应已达化学平衡状态 |
(2)CO与镍反应会造成含镍催化剂的中毒。为防止镍催化剂中毒,工业上常用SO2将CO氧化,二氧化硫转化为单质硫。
已知:CO (g)+1/2O2(g)=CO2(g) ΔH=-Q1 kJ·mol-1
S(s)+O2(g)=SO2(g) ΔH=-Q2 kJ·mol-1
则SO2(g)+2CO (g)=S(s)+2CO2(g) ΔH= 。
(3)对于反应:2NO(g)+O2 2NO2(g),向某容器中充入10mol的NO和10mol的O2,在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下随温度变化的曲线(如图)。
2NO2(g),向某容器中充入10mol的NO和10mol的O2,在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下随温度变化的曲线(如图)。
①比较P1、P2的大小关系:________________。
②700℃时,在压强为P2时,假设容器为1L,则在该条件平衡常数的数值为______(最简分数形式)
(4)NO2、O2和熔融NaNO3可制作燃料电池,其原理如图所示。该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应式为 。若该燃料电池使用一段时间后,共收集到20mol Y,则理论上需要消耗标准状况下氧气的体积为 L。
工业电解饱和食盐水模拟装置的结构如图所示:

(1)写出电解饱和食盐水的化学方程式 ,该工业称为 工业
(2)实际生产中使用的盐往往含有一些杂质,在电解食盐水之前,需要提纯食盐水。为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作,正确的操作顺序是
①过滤 ②加过量的NaOH溶液 ③加适量的盐酸 ④加过量的Na2CO3溶液 ⑤加过量的BaCl2溶液
| A.①④②⑤③ | B.④①②⑤③ | C.②⑤④①③ | D.⑤②④③① |
(3)在该装置中写出装NaOH溶液试管中所发生的化学反应方程式(并用双线桥表示电子的转移的方向和数目) 。
晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl SiHCl3+H2
SiHCl3+H2
③SiHCl3与过量H2在1000℃~1100℃反应制得纯硅
已知SiHCl3能与H2O强烈反应,在空气中易自燃。请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为__________________。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0℃)中含有少量SiCl4(沸点57.6℃)和HCl(沸点-84.7℃),提纯SiHCl3采用的方法为________________。
(3)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):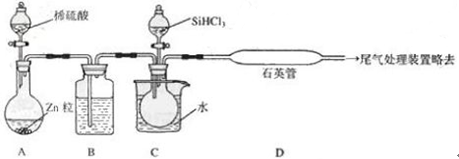
①装置B中的试剂是______。装置C中的烧瓶需要水浴加热,其目的是_____。
②反应一段时间后,装置D中观察到的现象是_______________,装置D不能采用普通玻璃管的原因是_______________,装置D中发生反应的化学方程式为_____________。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及_________。
④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂(填写字母代号)是____________。
a.碘水
b.氯水
c.NaOH溶液
d.KSCN溶液
e.Na2SO3溶液
(Ⅰ)A、B、C、D、E五种溶液分别为NaOH、NH3·H2O、CH3COOH、HCl、NH4HSO4中的一种。常温下进行下列实验:
①将1LpH=3的A溶液分别与0.001mol/L xLB溶液、0.001mol/L yLD溶液充分反应至中性,x、y大小关系为:y<x;
②浓度均为0.1mol/L A和E溶液,pH:A<E
③浓度均为0.1mol/L C与D溶液等体积混合,溶液呈酸性。
回答下列问题:
(1)D是_____________溶液
(2)用水稀释0.1mol/LB时,溶液中随着水量的增加而减小的是_____________(填写序号)
① ;②
;② ;③c(H+)和c(OH-)的乘积;④OH-的物质的量
;③c(H+)和c(OH-)的乘积;④OH-的物质的量
(3)OH-浓度相同的等体积的两份溶液A和E,分别和锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同,则下列说法正确的是_____________(填写序号)
①反应所需要的时间E>A ②开始反应时的速率A>E
③参加反应的锌粉物质的量A=E ④反应过程的平均速率E>A
⑤A溶液里有锌粉剩余 ⑥E溶液里有锌粉剩余
(4)将等体积、等物质的量浓度B和C混合后溶液,升高温度(溶质不会分解)溶液pH随温度变化如图中的_____________曲线(填写序号).
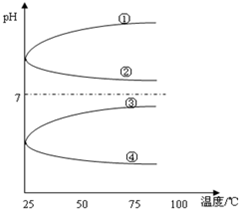
(5)室温下,向0.01mol/LC溶液中滴加0.01mol/LD溶液至中性,得到的溶液中所有离子的物质的量浓度由大到小的顺序为_____________.
(Ⅱ)如下图所示 ,横坐标为溶液的pH值,纵坐标为Zn2+离子或Zn(OH)42-离子物质的量浓度的对数,回答下列问题。
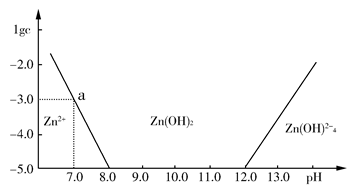
(1)往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为:_______________。
(2)从图中数据计算可得Zn(OH)2的溶度积(Ksp)=_______________。
(3)某废液中含Zn2+离子,为提取Zn2+离子可以控制溶液中pH值的范围是________________________。
(14分)铬(Cr)是周期表中VIB族元素,化合价可以是 0 ~+6 的整数价态。回答下列问题:
(1)某铬化合物的化学式为 Na3CrO8,其阴离子结构可表示为 ,则Cr的化合价为 。
,则Cr的化合价为 。
(2)在如图装置中,观察到Cu电极上产生大量的无色气泡,Cr电极周围出现天蓝色(Cr2+) ,而后又变成绿色 (Cr3+)。该电池总反应的过程表示为: ,2Cr2++2H+= 2Cr3++ H2。左侧烧杯溶液中c(Cl-) (填“增大”,“减小”或“不变”)。
(3)已知Ksp(BaCrO4)=1.2×10-10, Ksp(PbCrO4)= 2.8×10-13, Ksp(Ag2CrO4)= 2.0×10-12。某溶液中含有Ba2+、Pb2+、Ag+,浓度均为0.01 mol/L ,向该溶液中逐滴入 0.01 mol/L Na2CrO4溶液时,三种阳离子产生沉淀的先后顺序为 。
(4)在溶液中存在如下平衡:
则反应 的平衡常数K= 。
的平衡常数K= 。
(5)CrO2-4呈四面体构型,结构为 。CrO2-7由两个CrO2-4四面体组成,这两个CrO2-4四面体通过共用一个顶角氧原子彼连,结构为
。CrO2-7由两个CrO2-4四面体组成,这两个CrO2-4四面体通过共用一个顶角氧原子彼连,结构为 。则由n(n>1)个CrO2-4通过角顶氧原子连续的链式结构的化学式为 。
。则由n(n>1)个CrO2-4通过角顶氧原子连续的链式结构的化学式为 。
(6)CrO3是H2CrO4的酸酐,受热易分解。把一定量的 CrO3加热至790K时,残留固体的质量为原固体质量 76%。写出 CrO3受热分解化学方程式: 。
化合物A是尿路结石的主要成分,属于结晶水合物,可用X·nH2O表示。在一定条件下有如下图所示的转化关系:

已知:
①经分析,上图中的各字母代表的物质均由常见元素(原子序数≤20)组成,其中X由三种元素组成;A、D晶体中阴、阳离子个数比都是1∶1;D中的阳离子与C分子有相同的电子数,A中的阳离子与D中的阴离子的电子层结构相同。
② G、H是常见的气体单质,E、K、L是常见的气体化合物;E被人体吸入会与血红蛋白结合而使人中毒,K的大量排放是造成地球温室效应的一个主要原因。
③反应②、③是重要的化工反应,I是一种重要的化工原料。
④上图中的部分变化经定量测定,得到如右图所示的固体产物的质量m随温度[t (℃)]的变化曲线。回答下列问题:

(1)写出A的化学式: ,D中阴离子的结构示意图为 ;
(2)反应①的化学方程式为: 。
(3)K与G在一定条件下可生成多种物质,既可获得经济效益,也减少对环境的污染。
① 若O是一种易挥发的液态燃料,有毒,误饮5-10mL会导致双目失明。则O的分子式为: 。
② 若O是K与G按1∶3的比例反应而得,则O可能是 。(填编号)
A.烷烃 B.烯烃 C.炔烃 D.芳香烃
硅在地壳中的含量较高。硅及其化合物的开发由来已久,在现代生活中有广泛应用。回答下列问题:
(1)1810年瑞典化学家贝采利乌斯在加热石英砂、木炭和铁时,得到一种“金属”。这种“金属”可能是 。
(2)陶瓷、水泥和玻璃是常用的硅酸盐材料。其中生产普通玻璃的主要原料有 。
(3)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下: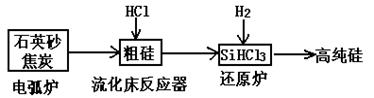
| |
发生的主要反应 |
| 电弧炉 |
SiO2+2C Si+2CO↑ Si+2CO↑ |
| 流化床反应器 |
Si+3HCl SiHCl3+H2 SiHCl3+H2 |
| 还原炉 |
SiHCl3+H2 Si+3HCl Si+3HCl |
①用石英砂和焦炭在电弧炉中高温加热也可以生产碳化硅,该反应的化学方程式为 ;碳化硅又称 ,其晶体结构与 相似。
②在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,有关物质的沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和 。
| 物质 |
Si |
SiCl4 |
SiHCl3 |
SiH2Cl2 |
SiH3Cl |
HCl |
SiH4 |
| 沸点/℃ |
2355 |
57.6 |
31.8 |
8.2 |
-30.4 |
-84.9 |
-111.9 |
③SiHCl3极易水解,其完全水解的产物为 。
(4)氯碱工业可为上述工艺生产提供部分原料,这些原料是 。
短周期主族元素A,B,C,D,E,F的原子序数依次增大,它们的原子核外电子层数之和为13。B的化合物种类繁多,数目庞大;C,D是空气中含量最多的两种元素,D,E两种元素的单质反应可以生成两种不同的离子化合物;F为同周期半径最小的元素。试回答以下问题:
(一)(1)D在周期表中的位置是 ,写出实验室制备单质F的离子方程式 。
(2)化学组成为BDF2的电子式为: ,A、C、F三种元素形成的化合物CA4F为 化合物(填 “离子”或“共价”)。
(3)化合物甲、乙由A,B,D,E中的三种或四种组成,且甲、乙的水溶液均呈碱性。则甲、乙反应的离子方程式为: 。
(4)由C,D,E,F形成的简单离子的离子半径由大到小的顺序是 (用元素离子符号表示)。
(5)元素B和F的非金属性强弱,B的非金属性 于F(填“强”或“弱”),并用化学方程式证明上述结论 。
(二)以CA3代替氢气研发氨燃料电池是当前科研的一个热点。
(1)CA3燃料电池使用的电解质溶液是2mol•L﹣1的KOH溶液,电池反应为:4 CA3+3O2=2C2+6H2O.该电池负极的电极反应式为 ;每消耗3.4g CA3转移的电子数目为 。
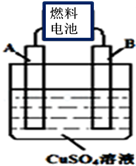
(2)用CA3燃料电池电解CuSO4溶液,如图所示,A、B均为铂电极,通电一段时间后,在A电极上有红色固体析出,则B电极上发生的电极反应式为 ;此时向所得溶液中加入8gCuO固体后恰好可使溶液恢复到电解前的浓度,则电解过程中收集到的气体在标准状况下体积为 L。
(3)常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,反应过程中有红棕色气体产生。

图1 图2
0~t1时,原电池的负极是Al片,此时,正极的电极反应式是 ,溶液中的H+向 极移动(填“正”或“负”),t1时,原电池中电子流动方向发生改变,其原因是 。
某学习小组进行了如下课外活动,邀请你参与:
(1)研究水溶液中复分解型离子反应的发生条件,设计如下方案:

①写出II实验中发生反应的离子方式: 。
②根据实验发现只要有 等物质生成,水溶液中复分解型离子反应就可以发生。
③经过小组同学积极思考、讨论交流发现在生成三类物质后,导致一个共同的结果,于是得出结论:溶液中复分解型的离子反应总是向着某些____ 的方向进行(与溶液混合的瞬间相比)。
④小组同学进一步深入思考,发现上述问题其实质是化学反应进行的方向问题。请你结合化学反应原理的相关知识对③中的结论作出合理解释: 。
(2)如何研究H2SO4、KC1、NaHSO4、NaNO3、Na2C03、NH4C1、NaOH的性质?设计方案为:将它们按照酸、碱、盐分类,然后分别溶于水得到溶液,进行实验。具体如下:
①根据方案进行分类时,经实验测得KC1、NaNO,溶液的pH=7;H2SO4、NaHSO4、NH4Cl溶液的pH<7; Na2CO3、NaOH溶液的pH>7。由此有的同学按分类法思想把H2SO4、NaHSO4、NH4CI都划分为酸类,请你运用中学化学相关理论判断这样划分是否合理?并简要说明理由。____ 、____ 。
②向NaHSO4、NaNO3的混合溶液中,滴加Na2S溶液产生黄色沉淀和无色气体,写出反应的离子方程式:________________。反应中若生成标准状况下的无色气体1.12L,则被氧化的物质为 mol,转移电子的物质的量为 mol。
③某同学在用H2SO4鉴别NaNO3、Na2CO3、NaOH溶液时,Na2CO3很容易鉴别,但鉴别NaNO3和NaOH时却陷入了困境。限用上述另外六种物质,请你设计一个现象明显的实验方案帮忙解决这一难题.
盐酸、硫酸和硝酸是中学阶段常见的“三大酸”。现就硫酸、硝酸与金属铜反应的情况,回答下列问题:
(1)工业上制备硫酸铜是利用废铜屑经灼烧后,在加热情况下跟稀硫酸反应,有关的化学方程式是: (两个);不采用铜跟浓硫酸反应来制取硫酸铜的原因是 (答两点)
(2)在一定体积的10 mol·L-1的浓硫酸中加入过量铜片,加热使之反应,被还原的硫酸为0.9 mol。则浓硫酸的实际体积 (填“大于”、“等于”或“小于”)180 mL。
(3)若使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(如KNO3溶液),则该反应的离子方程式为
(4)将8 g Fe2O3投入到150 mL某浓度的稀硫酸中,再投入7 g铁粉,充分反应后,收集到1.68 L H2(标准状况),同时,Fe和Fe2O3均无剩余,为了中和过量的硫酸,且使溶液中铁元素完全沉淀,共消耗4 mol·L-1的NaOH溶液150 mL。则原硫酸的物质的量浓度为
工业上冶炼冰铜(mCu2O·nFeS)可得到粗铜,在空气中煅烧冰铜时,产生一种有刺激性气味的气体A,该气体排放到空气中,是导致酸雨的形成的主要原因。

完成下列填空:
(1)为了降低污染气体A的排放,可选用下列试剂中的 (填序号)吸收。
a. 浓H2SO4 b. 浓HNO3 c. NaOH溶液 d.石灰乳
(2)已知铝在高温下能将某些金属从其氧化物中置换出来。将铝与泡铜发生反应从而得到粗铜。泡铜冶炼粗铜的化学方程式是 。每当有1mol铝参加反应,则转移电子个数为 ___
(3)SO2气体与氢氧化钠反应时,得到的盐为Na2SO3或 NaHSO3。通过计算回答:将0.3 mol SO2通入100mL含0.4 molNaOH溶液中,充分反应后得到的盐物质的量分别是多少?(写出计算过程)
氯气用途广泛,但在使用时,一般会产生氯化氢。工业上可用O2将HCl转化为Cl2,以提高效益,减少污染。反应为:
完成下列填空:
(1).该反应化学平衡常数K的表达式为 ;
实验测得P0压强下,HCl平衡转化率α(HCl)随反应温度T的变化如图所示,则正反应是 反应(填“吸热”或者“放热”)。
(2).上述实验中若压缩体积使压强由P0增大至P1,在图中画出P1压强下HCl平衡转化率α(HCl)随反应温度T变化的曲线,并简要说明理由: 。
(3).该反应在P0、320°C条件下进行,达平衡状态A时,测得容器内n(Cl2)=7.2×10–3mol,则此时容器中的n(HCl)= mol。
(4).对该反应达到平衡后,以下分析正确的是 (选填编号)。
a.增加n(HCl),对正反应的反应速率影响更大
b.体积不变加入稀有气体,对正反应的反应速率影响更大
c.压强不变加入稀有气体,对逆反应的反应速率影响更大
d.如果平衡常数K值增大,对逆反应的速率影响更大
(5).氯元素能形成多种离子。在水溶液中1molCl–、1mol ClOx–(x=1,2,3,4)能量的相对大小如图所示,写出B→A+C反应的热化学方程式(用离子符号表示) ;若有1.5molB发生反应,转移电子 mol。

氧化还原反应在生产、生活中具有广泛的用途、贯穿古今。
(1)水是人体的重要组成部分,是人体中含量最多的一种物质。而“四种基本反应类型与氧化还原反应的关系”也可用右下图表达。

试写出有水参加的符合反应类型Ⅳ的一个化学方程式:________________,其中水为________剂。
(2)过氧化氢俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。关于双氧水,回答下列问题:
①下列反应中,H2O2既体现氧化性又体现还原性的反应是( )
| A.Na2O2+2HCl═2NaCl+H2O2 |
B.Ag2O+H2O2═2Ag+O2↑+H2O |
| C.2H2O2═2H2O +O2↑ | |
| D.3H2O2+Cr2(SO4)3 +10KOH═2K2CrO4+3K2SO4+8H2O |
②保存过氧化氢的试剂瓶上最适合贴上的一个标签是( )(填序号)
(3)焊接铜器时,可先用NH4Cl 除去其表面的氧化铜再进行焊接,该反应可表示为:
4CuO + 2NH4Cl △ 3Cu + CuCl2 + N2↑+ 4H2O
①用双线桥标明电子转移的方向和数目。
②该反应中,被氧化的元素是 ,氧化剂是 。
③还原剂与氧化产物的物质的量之比为 。
④反应中若产生0.2 mol的氮气,则有 mol的电子转移。
化学反应原理在合成氨工业及氨的性质研究中具有广泛的应用。
(1)工业生产硝酸的第一步反应是氨的催化氧化反应,已知下列3 个热化学方程式(K 为平衡常数):

(2)工业合成氨所用的氢气主要来自天然气与水的反应,但这种原料气中往往混有一氧化碳杂质,工业生产中通过如下反应来除去原料气中的CO:CO(g)+H2O(g)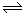 CO2(g)+ H2(g)ΔH<0。
CO2(g)+ H2(g)ΔH<0。
①一定条件下,反应达到平衡后,欲提高CO 的转化率,可采取的措施有 、 。
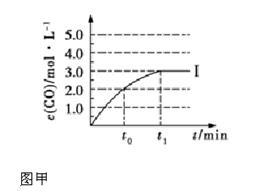
②在容积为2 L 的密闭容器中发生上述反应,其中c(CO)随反应时间(t)的变化如图甲中曲线Ⅰ,如果在t0时刻将容器容积扩大至4 L,请在图甲中画出t0时刻后c(CO)随反应时间(t)的变化曲线。
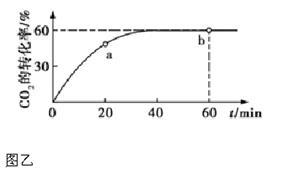
(3)氨气的重要用途是合成尿素,一定条件下,NH3和CO2 合成尿素的反应为 。当加料比例n(NH3)/n(CO2)="4" 时,CO2的转化率随反应时间(t)的变化如图乙所示,a 点v 逆(CO2) b 点v 正(CO2)(填“>”、“<”或“=”),NH3的平衡转化率为 。
。当加料比例n(NH3)/n(CO2)="4" 时,CO2的转化率随反应时间(t)的变化如图乙所示,a 点v 逆(CO2) b 点v 正(CO2)(填“>”、“<”或“=”),NH3的平衡转化率为 。
(4)硫酸工业生产过程中产生的尾气可用氨水吸收,生成的(NH4)2SO3再与硫酸反应,将生成的SO2返回车间作生产硫酸的原料,而生成的(NH4)2SO4可作肥料。常温下,0.1mol·L-1(NH4)2SO4溶液中各离子浓度由大到小的顺序是 ;
若某工厂中使用的是室温下0.1 mol·L-1的氨水,那么该氨水的pH= 。
(已知
试题篮
()