氨气是重要化工产品之一。传统的工业合成氨技术的反应原理是:
N2(g)+3H2(g)  2NH3(g) ΔH=-92.4 kJ/mol。在500 ℃、20 MPa时,将N2、H2置于一固定容积的密闭容器中反应,反应过程中各种物质的量变化如图所示,回答下列问题:
2NH3(g) ΔH=-92.4 kJ/mol。在500 ℃、20 MPa时,将N2、H2置于一固定容积的密闭容器中反应,反应过程中各种物质的量变化如图所示,回答下列问题:

(1)计算反应在第一次平衡时的平衡常数K= 。(保留二位小数)
(2)由第一次平衡到第二次平衡,平衡移动的方向是 ,采取的措施是 。
(3)45 min时刻改变的条件是 。
(4)产物NH3在5~10 min、25~30min和45~50 min时平均反应速率从大到小的排列次序为 (平均反应速率分别以v1、v2、v3表示)。
(5)随着条件的改变,达到三次平衡时H2的转化率也发生[了变化,如分别以α1、α2、α3表示,其中最小的是 。
(6)请在图中用实线表示25~45、45~60min 两阶段化学平衡常数K的变化图像。

25℃时,有关物质的电离平衡常数如下:
| 化学式 |
CH3COOH |
H2CO3 |
H2SO3 |
| 电离平衡常数 |
K=1.8×10-5 |
K1=4.3×10-7 K2=5.6×10-11 |
K1=1.5×10-2 K2=1.02×10-7 |
(1)三种酸由强至弱的顺序为 (用化学式表示)。
(2)常温下,0.02 mol·L-1的CH3COOH溶液的电离度约为 ,体积为10 mL pH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者 后者(填“>”、“<”或“=”)。
(3)下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+能力由大到小为 。
(4)c(NH4+)相同的下列物质的溶液中,物质的量浓度最大的是 。
A.NH4Al(SO4)2 B.NH4HCO3 C.NH4HSO4 D.NH4NO3 E.CH3COONH4
(5)等浓度的CH3COONa、NaHCO3的混合溶液中,各离子浓度关系正确的是 。
A.c(CH3COO-)>c(HCO3-)>c(OH-)
B.c(Na+)+c(H+) = c(CH3COO-)+c(HCO3-)+c(OH-)
C.c(OH-)>c(HCO3-)>c(CH3COO-)
D.c(CH3COO-)+c(CH3COOH) = c(HCO3-)+c(CO32-)
火箭推进剂由肼(N2H4)和液态过氧化氢组成,当它们混合反应时,即产生大量N2和H2O(g),并放出大量的热量。已知0.4mol液态肼与足量液态H2O2反应,生成N2和H2O(g)并放出256.65kJ热量。
(1)反应的热化学方程式为____________;
(2)反应中的氧化剂是_______;
(3)当放出256.65kJ热量时,转移电子数_______;
(4)此燃料的优点是____________________。
【化学-物物质结构与性质】原子序教依次增大的四种元素A、B、C、D分别处于第一至第四周期.自然界中存在多种A的化合物,B 原子核外电子有6 种不同的运动状态,B 与C可形成正四面体形分子.D 的基态原子的最外能层只有一个电子.其他能层均己充满电子。请回答下列问题:
(1)这四种元素中电负性最大的元素.其基态原子的价电子排布图为_________.第一电离能最小的元素是______(填元素符号)。
(2)C所在主族的前四种元素分别与A形成的化合物,沸点由高到低的顺序是_________(填化学式),呈现如此递变规律的原因是___________________。
(3)B元素可形成多种单质,一种晶体结构如图一所示,其原子的杂化类型为______、另一种的晶胞如图二所示,若此晶胞中的棱长为356.6pm,则此晶胞的密度为______g•cm-3(保留两位有效数字).( )
)

(4)D元素形成的单质,其晶体的堆积模型为_________,D的醋酸盐晶体局部结构如图三,该晶体中含有的化学键是_______(填选项序号).
①极性键 ②非极性键 ③配位键 ④金属键
【化学― 化学与技术】煤炭被人们誉为黑色的金子,它是人类使用的主要能源之一。为了提高煤的利用率,减少有害气体的排放.人们采取了各式各样的方法。
(1)煤的气化和液化可以提高煤的利用率.煤的气化技术的主要产物是_________。煤的液化技术又分为直接液化和间接氧化.将煤隔绝空气加强热得到焦炉气、煤焦油及焦炭等产品的技术称为__________。
(2)煤在燃烧前、后及燃烧过程中均可采取措施减少有害气体的排放。
①在燃烧前,可以采用微生物脱硫技术。原理如下:
上述过程中Fe2+的作用为__________。写出 的离子方程式______________。
的离子方程式______________。
②煤在燃烧时,进行脱硫处理,常采用_______燃烧技术,在把煤和脱硫剂加入锅炉燃烧室,使煤与空气在流化过程中充分混合、燃烧,起到固硫作用。常用脱硫剂的主要化学成分为_______(填化学式)。
③煤在燃烧后,烟气净化常采用除尘技术和脱硫、脱硝技术.湿法脱硫、脱硝技术中将烟气通入_______设备,用石灰水淋洗。
工厂中用稀硫酸浸泡某矿石后的溶液中,除了含有大量硫酸外.还含有少量NH4+、Fe3+、AsO43-、Cl-。为除去杂质离子,部分操作流程如下:
请回答问题:
(1)NH4+在用稀硫酸浸泡某矿石后的溶液中以(NH4)2SO4和NH4Cl形式存在.现有一份(NH4)2SO4溶液,一份NH4Cl溶液,(NH4)2SO4溶液中c(NH4+)恰好是NH4Cl溶液中c(NH4+)的2倍,则c[(NH4)2SO4]_____c(NH4Cl)(填:<、= 或 >) 。
(2)随着向废液中投入生石灰(忽略溶液温度的变化),溶液中 ______(填“增大”、“减小”或“不变”)。
______(填“增大”、“减小”或“不变”)。
(3)投入生石灰调节pH到2~3时,大量沉淀主要成分为CaSO4·2H2O[含有少量Fe(OH)3],提纯CaSO4·2H2O的主要步骤:向沉淀中加入过量_______,充分反应后,过滤、洗涤、______。
(4)25℃,H3AsO4电离常数为K1=5.6×10-3、K2=1.7×10-7、K3=4.0×10-12。当溶液中pH调节到8~9时,沉淀主要成分为Ca3(AsO4)2.
①pH调节到8左右Ca3(AsO4)2才开始沉淀的原因是________。
② Na3AsO4第一步水解的平衡常数数值为:________。
③已知:AsO43-+2I-+2H+= AsO43-+I2+H2O,SO2+I2+2H2O=SO42-+2I-+4H+。上述两个反应中还原性最强的微粒是_______。
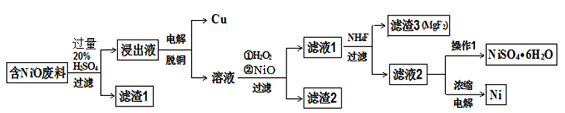
某NiO的废料中有FeO、CuO、Al2O3、MgO、SiO2等杂质,用此废料提取NiSO4和Ni的流程如下:
已知:有关金属离子生成氢氧化物沉淀所需的pH如下表:
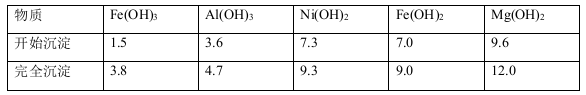
(1)滤渣1的主要成分为 。
(2)从滤液2中获得NiSO4.6H2O的实验操作 、 、过滤、洗涤、干燥。
(3)用离子方程式解释加入H2O2的作用 。
(4)加NiO调节溶液的pH至5,则生成沉淀的离子方程式有 。
(5)电解浓缩后的滤液2可获得金属镍,其基本反应原理如图:
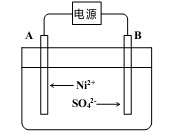
①A电极反应式为 和2H++2e- =H2↑。
②若一段时间后,在A、B两极均收集到11.2L气体(标准状况下),能得到Ni g。
(1)利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸。
已知:①N2(g)+O2(g)=2NO(g) △H="+180.5" kJ/mol
②N2(g)+3H2(g)  2NH3(g) △H=-92.4 kJ/mol
2NH3(g) △H=-92.4 kJ/mol
③2H2(g)+O2(g) = 2H2O(g) △H=-483.6 kJ/mol
氨催化氧化完全生成一氧化氮气体和水蒸气的热化学方程式为 。
(2)研究在其他条件不变时,改变起始物氢气的物质的量对N2(g)+3H2(g)  2NH3(g)反应的影响实验结果如图所示(图中T表示温度,n表示物质的量):
2NH3(g)反应的影响实验结果如图所示(图中T表示温度,n表示物质的量):

①图像中T2和T1的关系是:T2 T1(填“高于”“低于”“等于”“无法确定”)。
②a、b、c三点中,N2转化率最高的是 (填字母)。
③若容器容积为1L,T2℃在起始体系中加入1 mol N2,n(H2)=3mol,经过5 min反应达到平衡时H2的转化率为60%,则v(NH3)= 。保持容器体积不变,若起始时向容器内放入2 mol N2和6 mol H2,达平衡后放出的热量为Q,则Q___110.88 kJ(填“>”、“<”或“=”)。
按要求回答下列问题:
(1)有下列六种物质:①碳60(C60)晶体②硼晶体③Na2O晶体④ CaF2晶体⑤P4O10晶体⑥碳化硅晶体。其中属于离子晶体的是 ,属于分子晶体的是 ,属于原子晶体的是________________。
(2)有下列分子:HCN、P4、SO2、PCl3、BF3,其中属于非极性分子的是 。
(3)有下列离子:SO32-、SO42-、CO32-,其中空间构型为正四面体形的是 ,中心原子的杂化轨道类型属于sp2杂化的是 。
(4)CaO晶胞如图所示,CaO晶体中Ca2+的配位数为___________;与每一个钙离子距离最近并且距离相等的钙离子有____________个 。

铅蓄电池是典型的可充型电池,它的正负极格板是惰性材料,电池总反应式为:
Pb+PbO2+4H++2SO42- 2PbSO4+2H2O
2PbSO4+2H2O
请回答下列问题(不考虑氢、氧的氧化还原):
(1)放电时:正极的电极反应式是________________;电解液中H2SO4的浓度将变________;当外电路通过1 mol电子时,理论上负极板的质量增加________g
(2)在完全放电耗尽PbO2和Pb时,若按图连接
则电解一段时间后,在A电极上生成________、B电极上生成________,此时铅蓄电池的正负极的极性将________
炼油厂常将裂解产生的其它烯烃加氢,对产物再次裂解以提高乙烯产量。相关加成反应如下:
① (g)+H2(g)
(g)+H2(g)  CH3CH2CH2CH3(g) △H1
CH3CH2CH2CH3(g) △H1
② (g)+H2(g)
(g)+H2(g)  CH3CH2CH2CH3(g) △H2
CH3CH2CH2CH3(g) △H2
(1)已知反应①、反应②平衡常数K1、K2如下,下列叙述正确的是____;
| 温度(℃) |
300 |
320 |
340 |
| K1 |
4.8×10-4 |
2.5×10-4 |
1.3×10-4 |
| K2 |
8.4×105 |
3.5×103 |
1.6×103 |
A.△H1>0;△H2<0
B.反应①、反应②都是丙烯加氢,所以△H1=△H2
C.相同条件下反应②的转化率大于反应①的转化率
D.从平衡常数推测,相同条件下反应②的反应速率很大,反应①的反应速率很小
(2)2-丁烯的顺、反异构转换过程的△H=_______(用△H1、△H2表示)
 (g)
(g) 
 (g) △H
(g) △H
(3)在一定温度下,将等物质的量的反式2-丁烯和H2充入2L密闭容器中,发生反应②,容器内各物质浓度如图所示:

①前10分钟,平均反应速率v(H2)为______mol·L-1·min-1
②该温度下,此反应平衡常数K=_______(平衡常数不用写单位)
(4)已知表示H2和CH3CH2CH3标准燃烧热的热化学方程式为:
①H2(g)+ O2(g)
O2(g) H2O(l) △H=-285.8kJ•mol-1
H2O(l) △H=-285.8kJ•mol-1
②CH3CH2CH3(g)+5O2(g) 3CO2(g)+4H2O(l) △H=-2215kJ•mol-1
3CO2(g)+4H2O(l) △H=-2215kJ•mol-1
丁烯加成反应的热化学方程式为:
③CH3CH=CH2(g)+H2(g) CH3CH2CH3(g) △H=-125.4kJ•mol-1
CH3CH2CH3(g) △H=-125.4kJ•mol-1
则表示CH3CH=CH2标准燃烧热的热化学方程式为__________________。
Ⅰ 卤化物和卤酸盐在工业生产中有着重要的作用.某小组为探究其中一些盐的性质,查阅资料并进行实验.查阅资料如下:
①BrO3﹣+6I﹣+6H+=3I2+Br﹣+3H2O
②2BrO3﹣+I2=2IO3﹣+Br2
③IO3﹣+5I﹣+6H+=3I2+3H2O
④2IO3﹣+10Br﹣+12H+=I2+5Br2+6H2O
实验如下:
| 步骤 |
现象 |
| ⅰ.向盛有30mL 0.2mol•L﹣1 KI溶液的锥形瓶中依次 滴入几滴淀粉溶液和足量稀硫酸,再用滴定管逐滴加入KBrO3溶液 |
随着KBrO3溶液滴入,溶液由无色变为 蓝色并逐渐加深,最终保持不变 |
| ⅱ.继续向上述溶液中滴入KBrO3溶液 |
溶液的蓝色逐渐褪去 |
请回答:
(1)根据资料中的反应①~④并结合所学知识,判断IO3﹣、BrO3﹣、I2、Br2的氧化性由强到弱的顺序是 ;KBrO3溶液与KBr溶液在酸性条件下反应的离子方程式是 .
(2)若用y表示锥形瓶中含碘物质的物质的量,用x表示所滴入KBrO3的物质的量,在下图中画出上述整个实验过程中y随x的变化曲线(要求:在图中标出终点坐标).

Ⅱ 过碳酸钠中含有少量过氧化钠,甲、乙两位同学各称取一定质量的该样品,并用如下图所示仪器测定样品的纯度.仪器的连接顺序:
甲同学:⑤﹣⑧﹣③﹣⑦﹣④;
乙同学:⑤﹣③﹣②.
已知:过碳酸钠(Na2CO4)、过氧化钠分别跟足量稀硫酸反应的化学方程式如下:
2Na2CO4+2H2SO4═2Na2SO4+2CO2↑+O2↑+2H2O;
2Na2O2+2H2SO4═2Na2SO4+O2↑+2H2O.

(1)甲同学想通过实验测得的数据是 ,他选用的装置 (填序号)是没有必要的.
(2)乙同学想通过实验测得的数据是 .有人认为按他测得的数据计算出的实验结果可能偏高,原因是 ;为了测得准确的实验数据,请你将乙同学的实验设计进行改进,写出你所选用仪器的连接顺序(每种仪器最多使用一次,也可以不用): (填序号).
Ⅰ.下面的虚线框中每一列、每一行相当于周期表的每一族和每一周期,但它的列数和行数都多于元素周期表。

I.请在下面的虚线框中用实线画出周期表第一至第六周期的轮廓,并画出金属与非金属的分界线。(要求:左上角的第一个格是第一周期第IA族元素)
II.X、Y、Z、M、N为短周期的五种主族元素,其中X、Z同主族,Y、Z同周期,M与X,Y既不同族,也不同周期。X原子最外层电子数是核外电子层数的三倍,Y的最高化合价与其最低化合价的代数和等于6。N是短周期主族元素中原子半径最大的非金属元素。
(1)请写出下列元素的元素符号:X__________,Y__________,M__________。
(2)请写出N元素在周期表中的位置 周期、 主族;与N同族的短周期元素L,其最高价氧化物的电子式为 ;N的最高价氧化物与NaOH溶液反应离子方程式: 。
(3)Y与Z的最高价氧化物的水化物的酸性强弱 (用化学式表示)Y与Z相比,非金属性较强的元素是__________,可以证明该结论的实验是(用化学方程式表示) 。
高炉炼铁中发生的基本反应之一:FeO(s)+CO(g)⇌Fe(s)+CO2(g);正反应吸热
(l)已知1100℃时 K=0.263.应该反应化学平衡常数的表达式为 ,温度升高,化学平衡移动后达到新的平衡,平衡常数K值 .(填增大、减小或不变)
(2)1100℃时测得高炉中 c(CO2)=0.025mol/L,c(CO)=0.1mol/L,此时化学反应速率是v(正) v(逆)。(填=、>或<)
(3)在如图中画出在某时刻条件改变后的图象(其他条件不变).t1:增大CO的浓度 t2:降低温度.

工业电解饱和食盐水模拟装置的结构如图所示:

(1)写出电解饱和食盐水的化学方程式 ,该工业称为 工业
(2)实际生产中使用的盐往往含有一些杂质,在电解食盐水之前,需要提纯食盐水。为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作,正确的操作顺序是
①过滤 ②加过量的NaOH溶液 ③加适量的盐酸 ④加过量的Na2CO3溶液 ⑤加过量的BaCl2溶液
| A.①④②⑤③ | B.④①②⑤③ | C.②⑤④①③ | D.⑤②④③① |
(3)在该装置中写出装NaOH溶液试管中所发生的化学反应方程式(并用双线桥表示电子的转移的方向和数目) 。
试题篮
()