斑螯素能抑制肝癌的发展,去掉斑螯素中的两个甲基制得的化合物——去甲基斑螯素仍具有相应的疗效,其合成路线如下:
已知:① 2HCHO+NaOH→ CH3OH+HCOONa
② (Diels-Alder 反应)
(Diels-Alder 反应)
③当每个1,3-丁二烯分子与一分子氯气发生加成反应时,有两种产物: CH2ClCH=CHCH2Cl;CH2ClCHClCH=CH2。
请回答下列问题:
(1)物质A中含有的含氧官能团名称分别为 ;第①步反应中还生成另一产物,此产物的结构简式为 。
(2)写出H的结构简式 ;第⑤步反应的反应类型是 。
(3)去甲基斑螯素与X互为同分异构体。X能与FeCl3溶液发生显色反应,能与Na2CO3溶液反应生成气体,且其核磁共振氢谱有4个吸收峰。写出满足上述条件的X的一种结构简式 。
(4)结合题中有关信息,写出由 制备丁烯二酸酐
制备丁烯二酸酐 的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:
。
布噁布洛芬是一种消炎镇痛的药物。它的工业合成路线如下:
请回答下列问题:
(1)化合物A的分子式为 。
(2)A长期暴露在空气中会变质,其原因是 。
(3)由A到B的反应通常在低温时进行。温度升高时,多硝基取代副产物会增多。下列二硝基取代物中,最可能生成的是 (填字母,2分)。
a. b.
b. c.
c. d.
d.
(4)B被H2还原的产物C的结构简式为 。
(5)D→E的化学方程式为: 。
(6)F的结构简式 。
(7)D的同分异构体H是一种α-氨基酸,H可被酸性KMnO4溶液氧化成对苯二甲酸,则H的结构简式是 。
I.对羟基肉桂酸是一种强效的导电材料,在液晶显示器工业中近年来研究广泛。结构简式如下图:
(1)该有机物的分子式为 ,其含氧官能团的名称是 。
(2)该有机物能发生的反应类型是(填写代号) 。
A.氧化反应 B.消去反应 C.加聚反应 D.水解反应
II.芳香族化合物C10H10O2有如下的转化关系: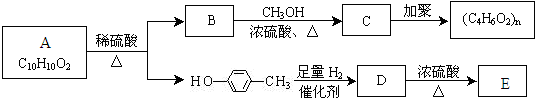
已知E能使Br2/CCl4溶液褪色。
(3)请分别写出A、C的结构简式:A 、 C 。
(4)若有机物F与C互为同分异构体且与有机物B互为同系物,则符合条件的F有 种(不考虑顺反异构)。
(5)请写出D→E反应的化学方程式: 。
(1)有机物的结构可用“键线式”简化表示。CH3—CH=CH-CH3可简写为 。
(2)有机物X的键线式为: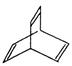 X与足量的H2在一定条件下反应可生成环状的饱和烃Z,Z的一氯代物有 种。
X与足量的H2在一定条件下反应可生成环状的饱和烃Z,Z的一氯代物有 种。
(3)有机物Y是X的同分异构体,且属于芳香烃,写出Y的结构简式: 。Y能使溴水褪色,其反应的化学方程式为___________________。Y可以用来合成一种聚合物---泡沫塑料,请写出该聚合物的结构简式___________。有机化学中有多种同分异构现象,其中有顺反异构,请写出Y的侧链多一个甲基的有机物W的两种顺反异构的结构简式: ______________,______________。
A、B、C、D、E为前四周期元素,原子序数依次增大。基态A原子的核外电子占据4个原子轨道;B与C同主族,大气平流层中单质B3浓度减少会致人患皮肤癌增加;D是前四周期元素中第一电离能最小的元素;E的合金是当今用量最大的合金。
(1)E2+的核外电子排布式为 。
(2)CB32-的立体构型是(用文字描述) ;其中心原子的杂化轨道类型为 。
(3)根据等电子原理,AB分子的电子式为 ;其中σ键与π键之比为 。
(4)[E(H2O)6]3+内E3+与H2O间的作用力为 。
(5)D2C的晶胞结构与CaF2晶胞(如图)相似,则Y应为 (填离子符号);D2C的熔点比CaF2熔点 (填“高”、“低”或“无法比较”)。
X是一种制备隐性眼镜的高分子材料,设计下列流程制取。经检测化合物A中只含有两种化学环境不同的氢原子。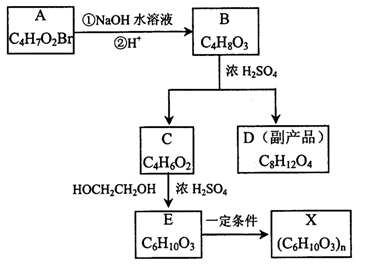
回答下列问题:
(1)化合物A的结构简式为 ,B→C的反应类型为 。
(2)写出符合下列条件的C的同分异构体的结构简式:
①不含支链的直链结构②属于酯类③能发生银镜反应
(3)D的结构简式为 。
(4)写出E→X反应的化学方程式: 。
下图表示某些化工生产的流程(部分反应条件和产物略去)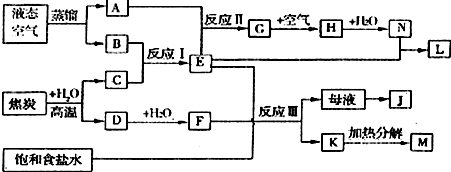
(1)反应Ⅰ需在500℃进行,其主要原因是 。
(2)G转化为H的过程中,需要不断补充空气,其原因是 。
(3)写出反应Ⅲ的化学方程式 。
(4)工业上,向析出K的母液中通氨气,加入细小食盐颗粒,冷却后可析出副产品。通入氨气的作用是 (填序号)。
a.增大NH+4的浓度,使J更多地析出
b.使K更多地析出
c.使K转化为M,提高析出的J的纯度
(5)写出上述流程所涉及的化学工业的名称 。
短周期元素在元素中占有重要地位。X、Y、Z三种短周期元素,它们的原子序数之和为16。X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如下变化: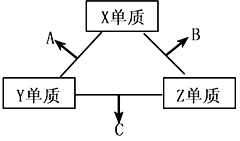
一个B分子中含有的Z原子个数比C分子中少1个,B、C两种分子中的电子数均等于10。请回答下列问题:
(1)X元素在周期表中的位置是________周期____________族 。
(2)分析同主族元素性质的递变规律,发现B、C物质沸点反常,这是因为它们的分子之间存在_____________ 。
(3)在C分子中,Y原子的杂化方式为 ,与Y原子同主族在第四周期的元素原子基态电子排布式是 。
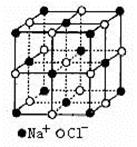
(4)NaCl的晶体结构如右上图所示,若将晶胞面心和体心的原子除去,顶点的钠离子换为Xn+(X代表某元素符号)离子,棱上的Cl-换为O2-,就得到X的氧化物的晶体结构。则该X的氧化物的化学式为 。
已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L电子层上有2对成对电子;E+原子核外有3层电子且各层均处于全满状态。
请填写下列空白。
(1)E元素基态原子的核外电子排布式为_________________。
(2)B、C、D三种元素的第一电离能数值由小到大的顺序为_____________(填元素符号),其原因为_____________________。
(3)B2A4是重要的基本石油化工原料。B2A4分子中B原子轨道的杂化类型为__________;
1 mol B2A4分子中含__________molσ键。
(4)已知D、E能形成晶胞如图所示的两种化合物,化合物的化学式,甲为__________,乙为_____________;高温时,甲易转化为乙的原因为__________________。
由中学化学常见元素组成的单质A、B、C和甲、乙、丙、丁、戊五种化合物有下图所示转化关系,A是由地壳中含量最多的金属元素组成的。请回答:
(1)写出下列物质的化学式:乙_______、丁_______、戊_______
(2)写出甲物质在工业上的一种主要用途:_______
(3)写出甲→乙+丙反应的离子方程式:____________
A→乙+C反应的化学方程式______________
X、Y、Z、W、Q五种元素原子序数依次增大,X为地壳中含量最高的元素,在周期表中Y与X、Z、Q相邻,Q与X最高能层上的电子数相同,W原子核外有七种不同能级的电子,且最高能级上没有未成对电子,W与X可形成W2X和WX两种化合物。
回答下列问题:
(1)X能与原子序数最小的元素形成原子个数比为1:1的分子,该分子的电子式为 。
(2)W2+的核外电子排布式为 。
(3)Z单质能溶于水,水液呈 色,在其中通人Y的某种氧化物,溶液颜色褪去,用化学方程式表示原因 。
(4)Y、Z元素的第一电离能Y Z(填“>”、“<”或“=”)。 X与地壳中含量第二的元素形成的化合物所属的晶体类型为 。
(5)已知X分别与元素碳、氮形成化合物有如下反应:
2CX(g)+X2(g)=2CX2(g) △H=—566.0kJ·mol-1
N2(g)+X2(g)="2NX(g)" △H=189.5kJ·mol-1
2NX(g)+X2(g)=2NX2(g) △H=—112.97kJ·mol-1
写出NX2与CX反应生成大气中存在的两种气态物质的热化学方程式: 。
(6)Y与磷原子形成P4Y3分子,该分子中没有π键,且各原子最外层均已达8电子结构,则一个P4Y3分子中含有的极性键和非极性键的个数分别为 个、 个。
A、B、C是与生命活动密切相关的三种常见化合物,每种物质所含元素种类均不超过三种,甲是单质。它们之间有如下转化关系:
化合物D也是生活中常见的化合物,在一定条件下可发生如下反应:D+3甲 3A+2B
3A+2B
请回答下列问题:
(1)在化合物A、B、C、D中所含元素完全相同的是__________和__________(填字母)。
(2)在常温下,A和B通过__________转化为C。该过程的能量转化关系如何?
____________________。
(3)写出由C生成D的反应的化学方程式____________________。
(4)化合物C是人类生命活动不可缺少的物质之一,它在血液中的正常含量是__________。
(5)目前化合物B在大气中含量呈上升趋势,对环境造成的影响是____________________。
已知乙烯能发生以下转化:
(1)乙烯的结构简式为:_________________________。
(2)写出下列化合物官能团的名称: D中含官能团名称____________。
(3)写出反应的化学方程式及反应类型:
②__________________________________________;反应类型:_____ ___。
③__________________________________________;反应类型:_____ __。
(4)B与D 反应的化学方程式:__________________________________________。
现有金属单质A、B、C和气体甲、乙、丙以及物质D、E、F、G、H,它们之间的相互转化关系如下图所示(图中有些反应的生成物和反应的条件没有标出)。
请回答下列问题:
(1)写出下列物质的化学式:B_________、丙_________、乙_________。
(2)写出下列反应的离子方程式:
反应①_____________________________________________;
反应⑤_____________________________________________;
反应⑥_____________________________________________。
已知A、B、C、D是中学化学中常见的四种不同粒子,它们之间存在如图所示的转化关系(反应条件已经略去):
(1) 如果A、B、C、D均是10电子的粒子,请写出A、D的化学式:
A____________ D_______________
(2)如果A和C是18电子的粒子,B和D是10电子的粒子,请写出:
① A与B在溶液中反应的离子方程式为:___________________________________
② 根据上述离子方程式,可以判断C与B结合质子的能力大小是(用化学式或离子符号表示)_________________________________________________。
试题篮
()