A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的原子半径最小;B元素的最高价氧化物对应水化物与其氢化物能生成盐M;D与A同主族,且与E同周期;E元素原子的最外层电子数比次外层电子数少2;A、B、D、E这四种元素,每一种与C元素都能形成原子个数比不相同的若干种化合物。请回答:
(1) C和E两种元素相比较,原子得电子能力较强的元素在周期表中的位置为 ,以下三种说法中,可以验证C和E得电子能力强弱的是(填写编号) ;
a.比较这两种元素的常见单质的沸点
b.二者形成的化合物中,C元素的原子显负价
c.比较这两种元素的气态氢化物的稳定性
(2)盐M中含有的化学键类型有 ;
(3)A、B、C、E可形成两种酸式盐(均含有该四种元素),这两种酸式盐在水溶液中相互反应的离子方程式为 。
(4)B2A4是一种可燃性液体,B2A4—空气燃料电池是一种碱性燃料电池,B2A4的氧化产物为B2。则负极上的电极反应式为 。
(5)已知1molD与水反应放出283.5kJ的热量,试写出D与水反应的热化学反应方程式 ;
有机物M和乙炔可合成3-羟基丁酸,3-羟基丁酸可以生成一种生物降解塑料PHB和通过两步反应生成另一种高聚物C:
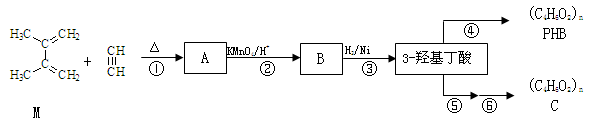
已知:i. 步骤②只有一种产物;C的结构中不含有甲基
ii. 
iii. 
41.M的系统命名为 。反应②反应类型 ,反应⑤的反应试剂及条件 。
42.写出B、C结构简式:B ,C 。
43.写出反应④化学方程式 ;
44.满足下列条件的B的同分异构体的结构简式为 。
a. 能发生银镜反应 b.分子中仅含2种化学环境不同的氢原子
45.理论上A也可以由1,3-丁二烯与烃F来合成,则F的结构简式为 。
信息时代产生的大量电子垃圾对环境构成了极大的威胁。某"变废为宝"学生探究小组将一批废弃的线路板简单处理后,得到含70%、25%
、4%
及少量
、
等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
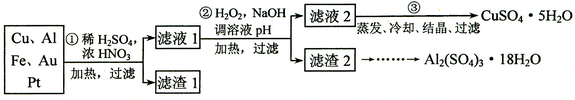
请回答下列问题:
⑴ 第①步与酸反应的离子方程为;
得到滤渣1的主要成分为。
⑵ 第②步加的作用是,使用H2O2的优点是;调溶液pH的目的是使生成沉淀。
⑶ 用第③步所得·
制备无水
的方法是。
⑷ 由滤渣2制取·18
,探究小组设计了三种方案:

上述三种方案中,方案不可行,原因是;
从原子利用率角度考虑,方案更合理。
⑸ 探究小组用滴定法测定·5
(
=250)含量。取
试样配成100
溶液,每次取20.00
,消除干扰离子后,用
标准溶液滴定至终点,平均消耗
溶液
。滴定反应如下:
+
=
+
写出计算·5
质量分数的表达式
=;
下列操作会导致·5
含量的测定结果偏高的是。
a.未干燥锥形瓶
b.滴定终点时滴定管尖嘴中产生气泡
c.未除净可与EDTA反应的干扰离子
以下各种有机化合物之间有如下的转化关系:
(1)D为一直链化合物,分子式为C4H8O2,它能跟NaHCO3反应放出CO2,D具有的官能团名称是 ,D的结构简式为 ;
(2)化合物C的分子式是C7H8O,C遇到FeCl3溶液显示紫色,C苯环上的一溴代物只有两种,则C的结构简式为 ;
(3)反应①的化学方程式是 ;
(4)芳香化合物B是与A具有相同官能团的A的同分异构体,通过反应②化合物B能生成E和F,F中有两个甲基,则F结构简式是 ;写出生成G的化学方程式 ;
(5)乙二醇和乙二酸可发生与D、F反应机理类似的反应生成高分子化合物,写出乙二醇与乙二酸在一定条件下生成高分子化合物的反应方程式 。
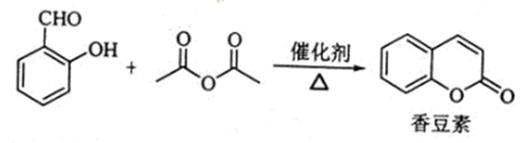
香豆浆是一种天然香料,存在于黑香豆、兰花等植物中。工业上常用水杨醛与乙酸酐在催化剂存在下加热反应制得:
以下是由甲苯为原料生产香豆素的一种合成路线(部分反应条件及副产物已略去)
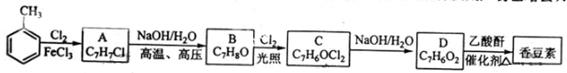
已知以下信息:
① A中有五种不同化学环境的氢
② B可与溶液发生显色反应
③ 同一个碳原子上连有连个羧基通常不稳定,易脱水形成羧基。
请回答下列问题:
(1) 香豆素的分子式为;
(2) 由甲苯生成A的反应类型为;A的化学名称为
(3) 由B生成C的化学反应方程式为;
(4) B的同分异构体中含有苯环的还有种,其中在核磁共振氢谱中只出现四组峰的有种;
(5) D的同分异构体中含有苯环的还有中,其中:
① 既能发生银境反应,又能发生水解反应的是(写解构简式)
② 能够与饱和碳酸氢钠溶液反应放出的是(写解构简式)
A、B、C是中学化学中常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去):

(1)若A是一种金属,C是淡黄色固体,则B的化学式为 ,A→C反应的化学方程式为 。
(2)若A是一种非金属,其常见单质为黑色固体,C是最主要的温室气体,则C的分子式为 ,B→C反应的化学方程式为 。
写出(1)中的C物质与(2)中的C物质反应的化学方程式: ,并用双线桥法表示上述反应中电子转移的方向和数目,如此反应转移0.5mol电子时,生成物中气体在标准状况下的体积为 。如在AlCl3溶液中投入足量的(1)中的C物质,则反应的离子方程式为 。
化合物 是鞘氨醇激酶抑制剂,其合成路线如图:
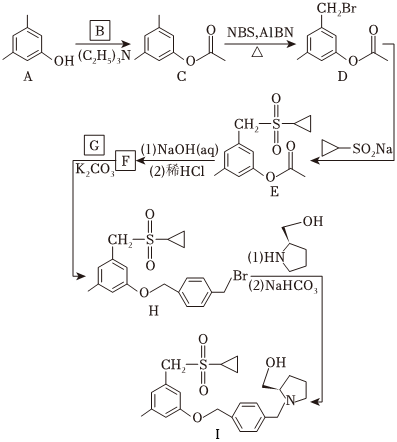
(1)化合物A的酸性比环己醇的_____(填“强”或“弱”或“无差别”)。
(2)B的分子式为 ,可由乙酸与 反应合成,B的结构简式为_____。
(3)A→C中加入 是为了结构反应中产生的_____(填化学式)。
(4)写出同时满足下列条件的C的一种同分异构体的结构简式:_____。碱性条件水解后酸化生成两种产物,产物之一的分子中碳原子轨道杂化类型相同且室温下不能使 酸性 溶液褪色;加热条件下,铜催化另一产物与氧气反应,所得有机产物的核磁共振氢谱中只有 个峰。
(5)G的分子式为 ,F→H的反应类型为_____。
(6)写出以 、
、 和
为原料制备
和
为原料制备 的合成路线流程图(须用
和
,无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
的合成路线流程图(须用
和
,无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
下列各物质转化关系如图所示,A是一种高熔点固体,D是一种红棕色固体。
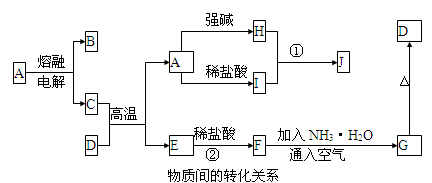
根据上述一系列关系回答:
(1)填写物质的化学式:B , G 。
(2)写出D物质中金属元素基态原子的核外电子排布图 。
(3)写出下列反应的离子方程式:
①H溶液和I溶液混合生成J___________ 。
②E和盐酸反应 。
(4)在电解熔融状态A的过程中,当电路中通过1mol电子时,阳极上产生的气体体积为 L。(标准状况下)
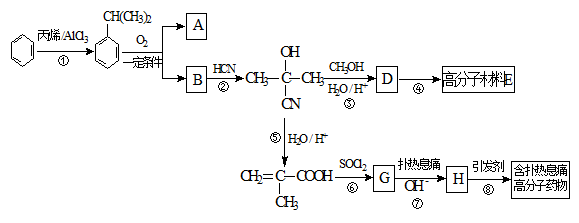
高分子材料E和含扑热息痛高分子药物的合成流程如下图所示:
已知:I.含扑热息痛高分子药物的结构为: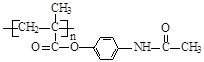 。
。
II.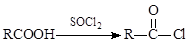
III.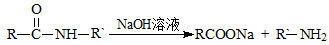
试回答下列问题:
(1)①的反应类型为____________,G的分子式为____________。
(2)若1 mol  可转化为1 mol A和1 mol B,且A与FeCl3溶液作用显紫色,写出A的稀溶液与过量浓溴水发生反应的化学方程式_____________。
可转化为1 mol A和1 mol B,且A与FeCl3溶液作用显紫色,写出A的稀溶液与过量浓溴水发生反应的化学方程式_____________。
(3)反应②为加成反应,则B的结构简式为__________;扑热息痛的结构简式为______________。
(4)写出含扑热息痛高分子药物与足量氢氧化钠溶液发生反应的化学方程式 。
(5)D蒸气密度是相同状态下甲烷密度的6.25倍,D中各元素的质量分数分别为碳60%,氢8%,氧32% 。D有多种同分异构体,其中属于链状酯类,且能发生银镜反应的同分异构体有_______种(考虑顺反异构)。
现有A、B、C、D、E五种原子序数依次增加的短周期元素,其中A的最低负价和最高正价代数和为零,且A2常温下为气态,B与其他元素形成的化合物种类最多,C与E可形成EC2和EC3两种物质,D是短周期最活泼的金属元素,用化学用语回答下列问题:
(1)D离子结构示意图_________________,B在元素周期表的位置_______________;
(2)A与C形成含18个电子的化合物的电子式是_______________;
(3)C与D形成的一种化合物颜色为淡黄色,其阴阳离子个数比为_____________,含有的化学键类型为___________;
(4)C、D、E的常见离子的离子半径由大到小的顺序__________________;
(5)B、E两元素得电子能力B________E(填“>”或“<”),试写出证明该结论的一个化学方程式_______;
(6)工业上常用氨水吸收尾气中的EC2,离子方程式为_______________________。
右图A→E是五种中学化学常见物质其中A、B、C、D常温下都是气体,B 为红棕色,A为气体单质。
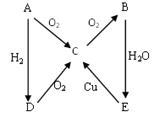
(1)写出化学式:B C
(2)实验室制备D实验中所用的干燥剂是: 。
(3)B与H2O反应,该反应的氧化剂和还原剂的物质的量之比为 。
(4)A与O2的反应方程式: ;D与O2的反应方程式:
;A与H2的反应方程式: 。
A、B、C、D、E为原子序数依次增大的短周期元素。A、C处于同一主族,C、D、E处于同一周期,E原子的最外层电子数是A、B、C原子最外层电子数之和,D是地壳中含量最高的金属元素;A、B组成的常见气体甲能使湿润的红色石蕊试纸变蓝;E的单质与甲反应能生成B的单质,同时生成两种水溶液均呈酸性的化合物乙和丙(该反应中氧化产物只有一种),25℃时0.1 mol/L的乙溶液pH>l;D的单质既能与C元素最高价氧化物的水化物的溶液反应生成盐丁,也能与丙的水溶液反应生成盐。
请回答下列问题:
(1)甲的化学式为 ;B单质的电子式为 。
(2)D元素的名称是 。
(3)写出丁溶液中通入过量二氧化碳时的离子方程式
(4)工业上利用A、B的单质合成甲(BA3):B2 (g)+3A2 (g)  2BA3 (g) △H<0,在一定温度下,在2 L密闭容器中,2 mol单质B2和1.6mol单质A2充分反应后达到平衡,测得BA3的物质的量浓度为0.4 mol/L,计算该温度下的平衡常数K=______________。
2BA3 (g) △H<0,在一定温度下,在2 L密闭容器中,2 mol单质B2和1.6mol单质A2充分反应后达到平衡,测得BA3的物质的量浓度为0.4 mol/L,计算该温度下的平衡常数K=______________。
(5)E的单质与甲反应生成的乙和丙的物质的量之比为2:4.反应中被氧化的物质与被还原的物质的物质的量之比为 。
A、B、C、D、X均为中学化学常见的物质。它们之间存在如下图所示转化关系(图中反应条件略去) 填写下列空白:

(1)若A为金属铝,B为氧化铁,写出反应A+B→C+D的一种用途 。
(2)若A为两性氢氧化物, B为NaOH溶液,写出反应A+B→C+D的离子方程式 。
(3)若A为金属单质,B、C、D都是化合物,A与B发生的反应常用于制作印刷电路板,该反应的离子方程式 。
(4)若A、B、C为化合物,D、X为单质,A、B、C中肯定含有X元素的是 。
A、B、C、D是四种常见的单质,A、B为金属;C、D常温下是气体,且D为黄绿色气体。甲、乙、丙为常见的化合物,甲物质具有磁性。它们之间有如图的转化关系:
请回答下列问题:
(1)B与甲反应的化学方程式是 。
B与NaOH溶液反应的离子方程式是 。
甲与足量盐酸溶液反应的离子方程式是 。
(2)含有B的阳离子的溶液与乙溶液反应得到一种白色沉淀,该反应的离子方程式是 。
(3)实验室检验丙溶液中所含金属阳离子的操作方法和现象是 。
试题篮
()