E的产量是衡量一个国家石油化工水平发展的标志,F为高分子化合物,能进行如图所示的反应。
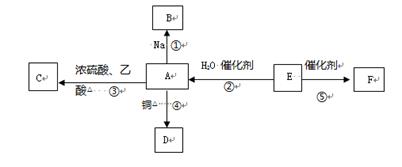
(1)请写出E的电子式 。
(2)下列反应的化学方程式:(要求有机物必须写结构简式)
反应②: ,反应类型 。
反应④: ,反应类型 。
反应⑤: ,反应类型 。
(3)比较反应①剧烈程度 (填>、= 或<)钠和水反应的剧烈程度。
有A、B、C、D、E五种常见化合物,都是由下表中的离子形成的:
| 阳离子 |
K+、Na+、Al3+、Cu2+ |
| 阴离子 |
OH-、HCO3-、NO3-、SO42- |
为了鉴别上述化合物。分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀完全溶解;
③进行焰色反应,B、C为紫色(透过蓝色钴玻璃),A、E为黄色;
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀,B中无明显现象。
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验填空:
(1)写出B、C的化学式:B ;C 。
(2)写出过量E滴人到C溶液中的离子反应方程式 。
(3)将含1 mol A的溶液与含1 mol E的溶液反应后蒸干,仅得到一种化合物,该化合物的化学式为 。
(4)在A溶液中加澄清石灰水,其离子方程式为 。
[化学—物质结构与性质]
A、B、C、D、E五种元素中,A原子核外的M层中只有两对成对电子,B原子核外的L层电子数是K层的两倍,C是地壳内含量(质量分数)最高的元素,D的核电荷数是A与C的核电荷数之和,E在元素周期表的各元素中电负性最大。请回答下列问题:
(1)A、B的元素符号依次为_____________、_______________;
(2)AC2与BC2分子的立体结构分别是______和______,相同条件下两者在水中的溶解度较大的是______(写分子式),理由是___________________________________________;
(3)D的核外电子排布式为________________________,在形成化合物时它的最高化合价为__________。
乙醇经下列步骤反应合成化合物C(分子式为C4H8O2),已知C是环状化合物且不能使溴水、KMnO4(H+)溶液褪色,反应路线如下:

(1)写出A.C结构简式:A , C ;
(2)写出x、y的反应类型:x 、y 。
右图A→E是五种中学化学常见物质其中A、B、C、D常温下都是气体,B 为红棕色,A为气体单质。
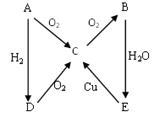
(1)写出化学式:B C
(2)实验室制备D实验中所用的干燥剂是: 。
(3)B与H2O反应,该反应的氧化剂和还原剂的物质的量之比为 。
(4)A与O2的反应方程式: ;D与O2的反应方程式:
;A与H2的反应方程式: 。
某化学小组用淀粉制取食品包装高分子材料B和具有果香味的物质D。其转化关系如下:

(1) C6H12O6名称是 ;A的电子式是 。
(2)写出下列反应方程式:
①淀粉一C6H12O6:
②C—D:
(3)写出常温下能与NaHCO3溶液反应的D的所有同分异构体的结构简式:
已知有以下物质相互转化,其中A为常见金属, C为碱。试回答:
(1)写出E的化学式__________,H的化学式___________。
(2)写出由E转变成F的化学方程式:______________________。
(3)向G溶液加入A的有关离子反应方程式:__________________。
(4)写出A在一定条件下与水反应的化学方程式:___________________。
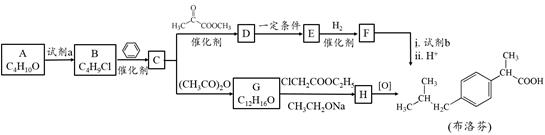
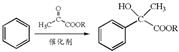
解热、镇痛药物布洛芬的两种合成路线如下:
已知: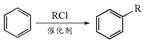 (R为烃基)
(R为烃基)
 (R为烃基)
(R为烃基)
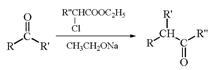 (R、R’、R’’为烃基或氢原子)
(R、R’、R’’为烃基或氢原子)
(1)A为醇,其核磁共振氢谱有四个吸收峰。A的结构简式是 。
(2)A与试剂a反应生成B的反应类型是 。
(3)由B生成C的化学方程式是 。
(4)D与E的相对分子质量相差18,由D生成E的化学反应方程式是 。
(5)G的结构简式是 ,H的含氧官能团的名称是 。
(6)布洛芬有多种同分异构体,写出满足下列条件的任意两种同分异构体的结构简式 。
a. 羧基与苯环直接相连 b. 苯环上有三个取代基,且苯环上的一氯代物有两种
某废金属屑中主要成分为Cu、Fe、Al,还含有少量的铜锈[Cu2(OH)2CO3]、少量的铁锈和少量的氧化铝,用上述废金属屑制取胆矾(CuSO4·5H2O)、无水AlCl3和铁红的过程如下图所示: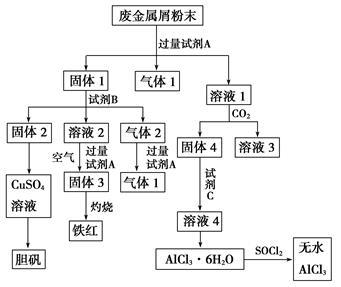
请回答:
(1)在废金属屑粉末中加入试剂A,生成气体1的反应的离子方程式是_________________。
(2)溶液2中含有的金属阳离子是__________;气体2的成分是______________。
(3)溶液2转化为固体3的反应的离子方程式是____________________________。
(4)利用固体2制取CuSO4溶液有多种方法。
①在固体2中加入浓H2SO4并加热,使固体2全部溶解得CuSO4溶液,反应的化学方程式是___________。
②在固体2中加入稀H2SO4后,通入O2并加热,使固体2全部溶解得CuSO4溶液,反应的离子方程式是_____________________________。
(5)溶液1转化为溶液4过程中,不在溶液1中直接加入试剂C,理由是__________________
(6)直接加热AlCl3·6H2O不能得到无水AlCl3。SOCl2为无色液体,极易与水反应生成HCl和一种具有漂白性的气体。AlCl3·6H2O与SOCl2混合加热制取无水AlCl3,反应的化学方程式是______________。
前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周期元素且相邻,A元素所形成的化合物种类最多,C、D、E、F是位于同一周期的金属元素,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数相差为10,基态D、E原子的价电子层中未成对电子数分别为4、2,且原子序数相差为2。
(1)六种元素中第一电离能最小的是_____________(填元素符号,下同)
(2)黄血盐是由A、B、C、D四种元素形成的配位化合物C4[D(AB)6],易溶于水,广泛用作食盐添加剂(抗结剂)。请写出黄血盐的化学式___ _,1molAB一中含有π键的数目为__ ______ (阿伏加德罗常数的值为NA),黄血盐晶体中各种微粒间的作用力不涉及____ (填序号)。
a .金属键. b.共价键 c.配位键 d.离子键 e.氢键 f.分子间的作用力
(3)E2+的价层电子排布图为 ,很多不饱和有机物在E催化下可与H2发生加成反应:如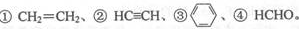 其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 ,它加成后产物甲醇的熔、沸点比CH4的熔、沸点高,其主要原因是 。
其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 ,它加成后产物甲醇的熔、沸点比CH4的熔、沸点高,其主要原因是 。
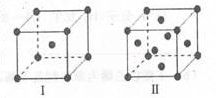
(4)金属C、F晶体的晶胞结构如图(请先判断对应的图),C、F两种晶体晶胞中金属原子的配位数之比为_ ___ 。金属C的晶胞中,若设该晶胞的密度为ag/cm3,阿伏加德罗常数的值为NA,C原子的摩尔质量为M g/mol,则表示C原子半径的计算式为 cm(不必化简)。
(以下化学反应关系转化图中,A的焰色反应呈黄色,E、F为有刺激性气味的气体,F也是造成酸雨的主要成分,G为强酸性溶液,H为既难溶于水、也难溶于稀酸的白色固体。试回答:

(1)写出化学式:A ;B 。
(2)写出下列反应的化学方程式或离子方程式:
① C→E(化学方程式):
② D+E+H2O→H(化学方程式):
③ E+F+H2O→G(离子方程式):
(3)C溶液电解的另一气体产物的燃烧热为285.8kJ/mol,写出该物质燃烧的热化学方程式: 。
(4)将F气体通入品红溶液中的现象是 ,由此现象说明F气体具有的性质是 。
我国女药学家屠呦呦因创制新型抗疟药青蒿素和双氢青蒿素而获得2015年诺贝尔生理学或医学奖。青蒿素的一种化学合成方法的部分工艺流程如图所示:



己知:①C6H5-表示苯基; ②
(1)化合物E中含有的含氧官能团有 、 和羰基(写名称)。
(2)1 mol化合物B最多可与_____________molH2发生加成反应。
(3)合成路线中设计E—→F、G-→H的目的是
(4)反应B→C,实际上可看作两步进行,依次发生的反应类型是 、_ __ _ 。
(5)A在Sn-p沸石作用下,可生成同分异构体异蒲勒醇,己知异蒲勒醇分子中有3个手性碳原子(连有四个不同基团的碳原子称为手性碳原子),异蒲勒醇分子内脱水后再与1分子H2发生1,4-加成可生成 则异蒲勒醇的结构简式为:
则异蒲勒醇的结构简式为:
(6)下图以乙烯为原料制备苄基乙醛 的合成路线流程图。
的合成路线流程图。

请填写下列空白(有机物写结构简式):
物质1为 ;物质2为 ;试剂X为 .条件3为 。
由中学化学常见元素组成的单质A、B、C和甲、乙、丙、丁、戊五种化合物有下图所示转化关系,A是由地壳中含量最多的金属元素组成的。请回答:
(1)写出下列物质的化学式:乙_______、丁_______、戊_______。
(2)写出甲物质在工业上的一种主要用途:_______。
(3)写出甲→乙+丙反应的离子方程式:____________,A→乙+C反应的化学方程式____________。
通过学习铁和铁的化合物的一些化学性质, 完成下列问题。
(1)高温下,铁粉与水蒸气反应的化学方程式是 ;
其中 为氧化剂。
(2)

①往A溶液中分别滴入几滴KSCN溶液,溶液A的颜色变化 。将A的饱和溶液滴入沸水中并不断加热,可制得 胶体;当光束通过该胶体时,可看到一条光亮的“通路”,这种现象称为
效应。
②写出上述过程中有关反应的离子方程式:
Fe2O3→A ;A→B 。
③C在空气中发生变化的现象是 。
A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如下的反应关系:
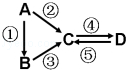
(1)若B是淡黄色固体,②③反应均用到同一种液态氢化物.D物质常用于食品工业.写出④反应的化学方程式 .
(2)若B是气态氢化物.C、D是氧化物且会造成光化学烟雾污染.写出③反应的化学方程式 .
(3)若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体.写出④反应离子方程式 .
(4)若A是太阳能电池用的光伏材料.C、D为钠盐,两种物质中钠、氧外的元素为同一主族,且溶液均显碱性.写出②反应的化学方程式 .
(5)若A是应用最广泛的金属.④反应用到A,②⑤反应均用到同一种非金属单质.写出④反应的离子方程式 .
试题篮
()