解释下列实验问题:
(1)浓盐酸易挥发,使产生的气体中含杂质HCl,为什么实验室还用浓盐酸与MnO2反应制Cl2而不使用稀盐酸?
(2)实验室用电石制乙炔时,通常用饱和食盐水代替水,并且用分液漏斗控制加入?
(3)实验室用Na2SO3固体和硫酸反应制取SO2气体时,既不用稀H2SO4,也不用浓H2SO4,而是用中等浓度的H2SO4,为什么?
当前城市空气质量恶劣的重要原因是汽车尾气的超标排放,你能否应用氮元素单质和化合物之间的转化关系,设计除去汽车尾气中的CO和氮氧化物(如NO、NO2等)的理论构想?其中包括:确定无害化过程及其产物和选择无害化试剂及反应条件等。
(1)将有害物质转化为什么物质即可完成无害化过程?
(2)应依据什么化学原理完成无害化过程?
(3)完成无害化过程中,无害化试剂的选择原则是什么?
(4)对无害化过程反应条件的确定原则是什么?
(5)写出无害化过程的化学方程式。
(8分)下图是一些常见的物质间的转化关系图。C是紫红色金属单质,G是蓝色沉淀,X是葡萄糖溶液,H是砖红色沉淀,F是形成酸雨的无色有害气体,所有反应物、生成物中的水均未标出;反应②的条件是使用浓B溶液和加热。

(1)A是 ,E是 ;
(2)电解A溶液时阴极的反应式 ;
(3)电解A溶液的总反应化学方程式是 。
试用蛋白质的性质,解释下列现象。
(1)在豆浆中加入石膏或氯化镁,能使豆浆凝结为豆腐。
(2)误服可溶性重金属盐,可以服用大量牛奶,蛋清或豆浆解毒。
(3)福尔马林能防腐,可用于浸制标本。
(4)用灼烧的方法可鉴别毛织物和棉织物。
(4分)有一包固体粉末,由CaCO3、Na2SO4、KNO3、BaCl2、CuSO4中的三种物质组成,取样品进行如下实验:
从实验可以判断,该固体粉末中
(1)一定不含有 。
(2)写出无色气体的分子式 。
判断下列说法是否正确:
| A.1mol任何气体的体积都是22.4L( ) |
| B.标准状况下,1mol任何物质所占有的体积都约是22.4L( ) |
| C.标准状况下,1mol任何气体的体积都约是22.4L ( ) |
| D.标准状况下,1L H2和1L水的物质的量相同 ( ) |
E.若1mol气体的体积约为22.4L,则它一定处于标准状况下. ( )
(1)有机物A只含C、H、O三种元素,其相对分子质量为62,A经催化氧化生成D,D经催化氧化生成E,A与E在一定条件下反应可生成一种环状化合物F。
则A的分子式为 ,结构简式为 ;
A与E反应生成F的化学方程式为 。
(2)对有机物B的组成、结构、性质进行观察、分析,得实验结果如下:
①B为无色晶体,微溶于水,易溶于Na2CO3溶液;
②完全燃烧166mg有机物B,得到352mgCO2和54mgH2O;
③核磁共振氢谱显示B分子中只有2种不同结构位置的氢原子;
④B的相对分子质量在100~200之间。
B的分子式为 ,结构简式为 。
(3)A与B在一定条件下反应可生成一种常见合成纤维,该高分子化合物的结构简式为 。
(4)B的一种同分异构体(与B具有相同的官能团),在一定条件下可发生分子内脱水生成一种含有五元环和六元环的有机物G,G的结构简式为 。
(5)E可将酸性高锰酸钾溶液还原,所得还原产物为Mn2+,该反应的离子方程式为
。
某有机物X(C12H13O6Br)分子中含有多种官能团,其结构简式为
 (其中I、II为未知部分的结构)
(其中I、II为未知部分的结构)
为推测X的分子结构,进行如图的转化:

已知向E的水溶液中滴入FeCl3溶液发生显色反应;M(C2H2O4)能使蓝墨水褪色;G、M都能与NaHCO3溶液反应。请回答:
(1)M的结构简式为 ;G分子所含官能团的名称是 ;
(2)E可以发生的反应有(选填序号) ;
①加成反应 ②消去反应 ③氧化反应 ④取代反应
(3)G在一定条件下发生反应生成分子组成为C4H4O4的有机物(该有机物可使溴的四氯化碳溶液褪色),写出G发生此反应的化学方程式
;
(4)已知在X分子结构中,I结构含有能与FeCl3溶液发生显色反应的官能团,且E分子中苯环上的一氯代物只有一种,则X的结构简式是 ;
(5)F与G互为同分异构体,F的分子中只含有羧基、羟基和醛基三种官能团,且同一个碳原子上不能同时连有两个羟基。则F的分子结构可能为 。
由短周期元素组成的单质A、B、C和甲、乙、丙、丁四种化合物有下图所示的转换关系,已知C为密度最小的气体。
根据图示转化关系回答:
(1)写出下列物质的化学式:B 、丙 、丁 。
(2)组成单质A的元素在周期表中的位置是 。
(3)乙与过量CO2反应的离子反应方程式____________________________
(4)A与NaOH溶液反应的化学反应方程式____________________________
X、Y、Z、M是元素周期表中前20号元素,其原子序数依次增大,且X、Y、Z相邻。X的核电荷数是Y的核外电子数的一半,Y与M可形成化合物M2Y。用微粒符号完成下列问题:
(1)Y、Z两种元素的最高价氧化物的水化物酸性 强于 。
(2)M、Z、Y形成的简单离子的半径的大小 。
(3)M2X2固体中阴、阳离子个数比____________, 其电子式为 .该物质中含有化学键的类型有 和 .
(4)将Z的单质通入YX2的水溶液中发生反应的离子方程式为 。
瑞士化学家米勒因合成DDT于1948年获得诺贝尔医学奖。在第二次世界大战中的1944年,美国在意大利的许多士兵因使用DDT来扑灭传染斑疹伤寒流行病人身上的虱子而避免丧生。联合国世界卫生组织曾评价说:“单独从疟疾病者,DDT可能拯救了5000万生命。”
但进一步的观察和研究表明,DDT是一种难降解的有毒化合物,进入人体内可引起慢性中毒。我国已于1983年停止生产和使用。
(1)杀虫剂“1605”本身对人畜毒性远强于DDT,但DDT已被禁用,而“1605”尚未禁用,这是为什么?
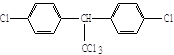
杀虫剂“1605” 杀虫剂DDT
由结构分析知:“1605”在使用过程中,不能与 物质混合使用,否则会因
(2)DDT可以用电石为原料经以下途径而制得;
①写出④、⑤、⑥步反应的化学方程式。
②DDT有毒性,国际上已禁止使用,因为它在动物体内转化为一种使动物生长失调的物质(结构如右面所示结构式)。在实验室也可实现这种转化,表示这种转化的化学方程式为
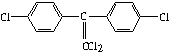
用阿司匹灵治疗头痛、防治心脏病和中风已有百年历史。伦敦帝国学院和哈默史密斯医院前列腺生物学小组的医生们进行的最新研究显示,阿司匹灵还可能阻止或减缓与癌肿瘤增大有关的cox-2酶的生成。阿司匹灵(化学名为:乙酰水杨酸)的结构简式为: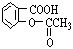 若将阿司匹灵溶于过量的氢氧化钠溶液,其反应的化学方程式为:_________________________
若将阿司匹灵溶于过量的氢氧化钠溶液,其反应的化学方程式为:_________________________
科学家把药物连在高分子载体上,可制成缓释长效药剂。如:阿司匹灵可连接在某高分子聚合物上,形成缓释长效药剂。其中一种的结构简式为:

该药体在人体内可能通过水解作用缓缓释放出阿司匹灵,有关的化学方程式:
___________________________________________________
现欲以丙烯为基本原料,通过以下途径合成缓释长效阿司匹灵中的高分子载体。
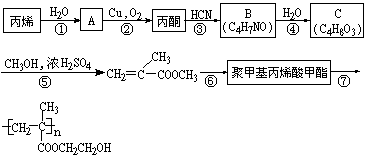
在上述反应中,属于加成反应的有:____________;属于氧化反应的有:____________。
已知:在硫酸存在及加热、加压的条件下,有利于反应①进行。试指出硫酸在该反应过程中所起的作用是什么?____________。加热、加压有利于该反应进行的原因是什么?
下列是芳香族化合物A、B、C、D、E的转化关系,其中A、E分子式分别是C9H8O和C9H8O2,E分子中除苯环外还含有一个六元环,且E中不含甲基。根据下列转化关系回答问题:
(1)写出A分子中所含官能团的名称________________________________。
(2)完成方程式,并分别写出反应类型
A→B___________________________________________反应类型__________________。
B→C___________________________________________反应类型__________________。
(3)写出E的结构简式______________________________。
(4)要中和16.6gD,需要2mol/LNaOH溶液的体积为_________mL。
(5)符合下列条件的D的同分异构体共有_________种,写出其中任意一种同分异构体的结构简式______________________________________。
①苯环上有两个取代基 ②能与FeCl3溶液发生显色反应 ③能发生水解反应和银镜反应
试题篮
()