沿海电厂采用海水为冷却水,但在排水管中生物的附着和滋生会阻碍冷却水排放并降低冷却效率。为解决这一问题,通常在管道口设置一对惰性电极 (如图所示),通入一定的电流。下列叙述错误的是( )
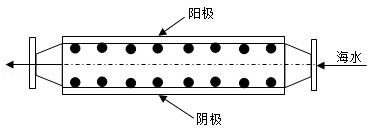
| A. | 阳极发生将海水中的 氧化生成 的反应 |
| B. | 管道中可以生成氧化灭杀附着生物的 |
| C. | 阴极生成的 应及时通风稀释安全地排入大气 |
| D. | 阳极表面形成的 等积垢需要定期清理 |
我国嫦娥五号探测器带回1.731kg的月球土壤,经分析发现其构成与地球土壤类似。土壤中含有的短周期元素W、X、Y、Z,原子序数依次增大,最外层电子数之和为15。X、Y、Z为同周期相邻元素,且均不与W同族。下列结论正确的是( )
| A. |
原子半径大小顺序为 |
| B. |
化合物XW中的化学键为离子键 |
| C. |
Y单质的导电性能弱于Z单质的 |
| D. |
Z的氧化物的水化物的酸性强于碳酸 |
一种活性物质的结构简式为 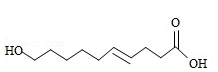 ,下列有关该物质的叙述正确的是( )
,下列有关该物质的叙述正确的是( )
| A. | 能发生取代反应,不能发生加成反应 |
| B. | 既是乙醇的同系物也是乙酸的同系物 |
| C. | 与 |
| D. | 1mol该物质与碳酸钠反应得44g |
下列过程中的化学反应,相应的离子方程式正确的是( )
| A. |
用碳酸钠溶液处理水垢中的硫酸钙: |
| B. |
过量铁粉加入稀硝酸中: |
| C. |
硫酸铝溶液中滴加少量氢氧化钾溶液: |
| D. |
氯化铜溶液中通入硫化氢: |
在实验室采用如图装置制备气体,合理的是( )
| |
化学试剂 |
制备气体 |
| A. |
|
|
| B. |
|
|
| C. |
|
|
| D. |
|
|

| A. | A |
B. | B |
C. | C |
D. | D |
我国提出争取在2030年前实现碳达峰、2060年前实现碳中和,这对于改善环境、实现绿色发展至关重要。"碳中和"是指 的排放总量和减少总量相当。下列措施中能促进碳中和最直接有效的是( )
| A. | 将重质油裂解为轻质油作为燃料 |
| B. | 大规模开采可燃冰作为新能源 |
| C. | 通过清洁煤技术减少煤燃烧污染 |
| D. | 研发催化剂将 还原为甲醇 |
近年来,以大豆素(化合物C)为主要成分的大豆异黄酮及其衍生物,因其具有优良的生理活性而备受关注.大豆素的合成及其衍生化的一种工艺路线如下:
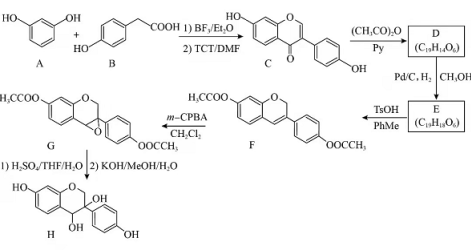
回答下列问题:
(1)A的化学名称为_______。
(2) 反应生成E至少需要______ 氢气。
(3)写出E中任意两种含氧官能团的名称_______。
(4)由E生成F的化学方程式为_________。
(5)由G生成H分两步进行:反应1)是在酸催化下水与环氧化合物的加成反应,则反应2)的反应类型为________。
(6)化合物B的同分异构体中能同时满足下列条件的有_______(填标号)。
a.含苯环的醛、酮
b.不含过氧键( )
c.核磁共振氢谱显示四组峰,且峰面积比为3∶2∶2∶1
| A. |
2个 |
B. |
3个 |
C. |
4个 |
D. |
5个 |
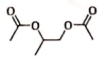
(7)根据上述路线中的相关知识,以丙烯为主要原料用不超过三步的反应设计合成:
我国科学家研发的全球首套千吨级太阳能燃料合成项目被形象地称为"液态阳光"计划。该项目通过太阳能发电电解水制氢,再采用高选择性催化剂将二氧化碳加氢合成甲醇。回答下列问题:
(1)太阳能电池板主要材料为单晶硅或多晶硅。Si的价电子层的电子排布式为______;单晶硅的晶体类型为_______。SiCl 4是生产高纯硅的前驱体,其中Si采取的杂化类型为______。SiCl 4可发生水解反应,机理如下:
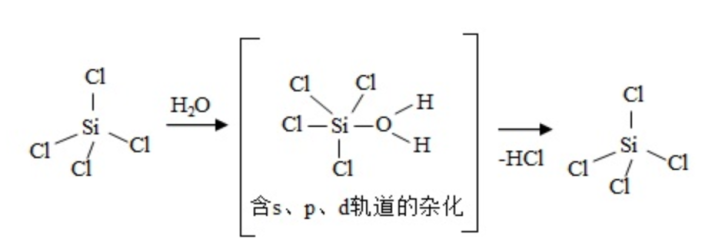
含s、p、d轨道的杂化类型有:①dsp 2、②sp 3d、③sp 3d 2,中间体SiCl 4(H 2O)中Si采取的杂化类型为_______ (填标号)。
(2)CO 2分子中存在________个σ键和________个π键。
(3)甲醇的沸点(64.7℃)介于水(100℃)和甲硫醇(CH 3SH,7.6℃)之间,其原因是_____________。
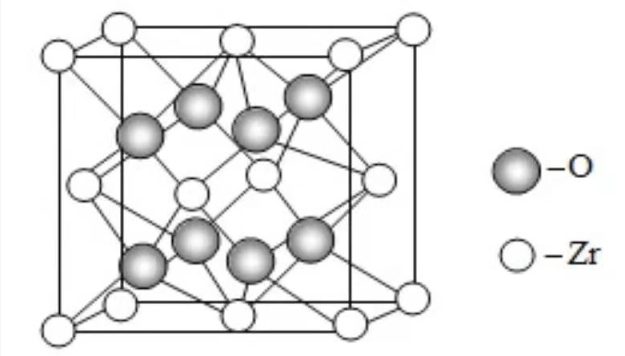
(4)我国科学家发明了高选择性的二氧化碳加氢合成甲醇的催化剂,其组成为ZnO/ZrO 2固溶体。四方ZrO 2晶胞如图所示。Zr 4+离子在晶胞中的配位数是____________,晶胞参数为 apm、 apm、 cpm,该晶体密度为____________g·cm -3(写出表达式)。在ZrO 2中掺杂少量ZrO后形成的催化剂,化学式可表示为Zn xZr 1- xO y,则 y=____________(用 x表达)。
二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。回答下列问题:
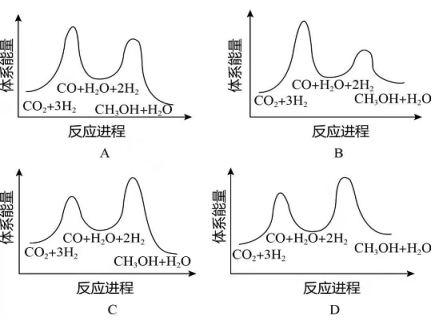
(1)二氧化碳加氢制甲醇的总反应可表示为:
该反应一般认为通过如下步骤来实现:
①
②
总反应的 _______ ;若反应①为慢反应,下列示意图中能体现上述反应能量变化的是________(填标号),判断的理由是_______。
(2)合成总反应在起始物 时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为 ,在 ℃下的 、在 下的 如图所示。
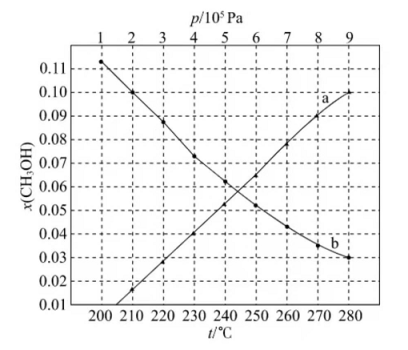
①用各物质的平衡分压表示总反应的平衡常数,表达式 ________;
②图中对应等压过程的曲线是________,判断的理由是_________;
③当 时, 的平衡转化率 __________,反应条件可能为________或_______。
胆矾( )易溶于水,难溶于乙醇。某小组用工业废铜焙烧得到的 (杂质为氧化铁及泥沙)为原料与稀硫酸反应制备胆矾,并测定其结晶水的含量。回答下列问题:
(1)制备胆矾时,用到的实验仪器除量筒、酒精灯、玻璃棒、漏斗外,还必须使用的仪器有________(填标号)。
| A. |
烧杯 |
B. |
容量瓶 |
C. |
蒸发皿 |
D. |
移液管 |
(2)将 加入到适量的稀硫酸中,加热,其主要反应的化学方程式为___________,与直接用废铜和浓硫酸反应相比,该方法的优点是_________。
(3)待 完全反应后停止加热,边搅拌边加入适量 ,冷却后用 调 为3.5~4,再煮沸 ,冷却后过滤。滤液经如下实验操作:加热蒸发、冷却结晶、________、乙醇洗涤、________,得到胆矾。其中,控制溶液 为3.5~4的目的是_________,煮沸 的作用是_________。
(4)结晶水测定:称量干燥坩埚的质量为 ,加入胆矾后总质量为 ,将坩埚加热至胆矾全部变为白色,置于干燥器中冷至室温后称量,重复上述操作,最终总质量恒定为 。根据实验数据,胆矾分子中结晶水的个数为_________(写表达式)。
(5)下列操作中,会导致结晶水数目测定值偏高的是________(填标号)。
| A. |
①胆矾未充分干燥 |
| B. |
②坩埚未置于干燥器中冷却 |
| C. |
③加热时有少胆矾迸溅出来 |
碘(紫黑色固体,微溶于水)及其化合物广泛用于医药、染料等方面。回答下列问题:
(1) 的一种制备方法如下图所示:
①加入 粉进行转化反应的离子方程式为_________,生成的沉淀与硝酸反应,生成________后可循环使用。
②通入 的过程中,若氧化产物只有一种,反应的化学方程式为__________;若反应物用量比 时,氧化产物为_________;当 ,单质碘的收率会降低,原因是___________。
(2)以 为原料制备 的方法是:先向 溶液中加入计量的 ,生成碘化物;再向混合溶液中加入 溶液,反应得到 ,上述制备 的总反应的离子方程式为__________。
(3) 溶液和 溶液混合可生成 沉淀和 ,若生成 ,消耗的 至少为_______ 。 在 溶液中可发生反应: 。实验室中使用过量的 与 溶液反应后,过滤,滤液经水蒸气蒸馏可制得高纯碘。反应中加入过量 的原因是________。
乙醛酸是一种重要的化工中间体,可果用如下图所示的电化学装置合成。图中的双极膜中间层中的 解离为 和 ,并在直流电场作用下分别问两极迁移。下列说法正确的是( )
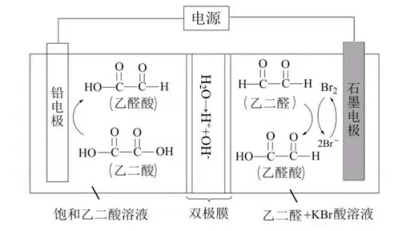
| A. |
在上述电化学合成过程中只起电解质的作用 |
| B. |
阳极上的反应式为: |
| C. |
制得 乙醛酸,理论上外电路中迁移了 电子 |
| D. |
双极膜中间层中的 在外电场作用下向铅电极方向迁移 |
已知相同温度下, 。某温度下,饱和溶液中 、 与 的关系如图所示。

下列说法正确的是( )
| A. |
曲线①代表 的沉淀溶解曲线 |
| B. |
该温度下 的 值为 |
| C. |
加适量 固体可使溶液由a点变到b点 |
| D. |
时两溶液中 |
W、X、Y、Z为原子序数依次增大的短周期主族元素,Z的最外层电子数是W和X的最外层电子数之和,也是Y的最外层电子数的2倍。W和X的单质常温下均为气体。下列叙述正确的是( )
| A. |
原子半径: |
| B. |
W与X只能形成一种化合物 |
| C. |
Y的氧化物为碱性氧化物,不与强碱反应 |
| D. |
W、X和Z可形成既含有离子键又含有共价键的化合物 |
试题篮
()