实验室制备下列气体的方法可行的是( )
| |
气体 |
方法 |
| A |
氨气 |
加热氯化铵固体 |
| B |
二氧化氮 |
将铝片加到冷浓硝酸中 |
| C |
硫化氢 |
向硫化钠固体滴加浓硫酸 |
| D |
氧气 |
加热氯酸钾和二氧化锰的混合物 |
为阿伏加德罗常数的值,下列叙述正确的是( )
| A. |
重水( )中含有的质子数为 |
| B. |
的 与 完全反应时转移的电子数为 |
| C. |
环状
( |
| D. |
的 溶液中 离子数为 |
化学与人体健康及环境保护息息相关。下列叙述正确的是( )
| A. |
食品加工时不可添加任何防腐剂 |
| B. |
掩埋废旧电池不会造成环境污染 |
| C. |
天然气不完全燃烧会产生有毒气体 |
| D. |
使用含磷洗涤剂不会造成水体污染 |
某同学利用Cl2氧化K2MnO4制备KMnO4的装置如图所示(夹持装置略):
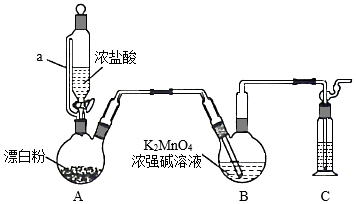
已知:锰酸钾(K2MnO4)在浓强碱溶液中可稳定存在,碱性减弱时易发生反应:3MnO42﹣+2H2O═2MnO4﹣+MnO2↓+4OH﹣
回答下列问题:
(1)装置A中a的作用是 ;装置C中的试剂为 ;装置A中制备Cl2的化学方程式为 。
(2)上述装置存在一处缺陷,会导致KMnO4产率降低,改进的方法是 。
(3)KMnO4常作氧化还原滴定的氧化剂,滴定时应将KMnO4溶液加入 酸式 (填“酸式”或“碱式”)滴定管中;在规格为50.00 mL的滴定管中,若KMnO4溶液起始读数为15.00 mL,此时滴定管中KMnO4溶液的实际体积为 (填标号)。
A.15.00 mL B.35.00 mL C.大于35.00 mL D.小于15.00 mL
(4)某FeC2O4•2H2O样品中可能含有的杂质为Fe2(C2O4)3、H2C2O4•2H2O,采用KMnO4滴定法测定该样品的组成,实验步骤如下:
Ⅰ.称取mg样品于锥形瓶中,加入稀H2SO4溶解,水浴加热至75℃.用c mol•L﹣1的KMnO4溶液趁热滴定至溶液出现粉红色且30s内不褪色,消耗KMnO4溶液V1mL。
Ⅱ.向上述溶液中加入适量还原剂将Fe3+完全还原为Fe2+,加入稀H2SO4酸化后,在75℃继续用KMnO4溶液滴定至溶液出现粉红色且30s内不褪色,又消耗KMnO4溶液V2 mL。
样品中所含H2C2O4•2H2O(M=126g•mol﹣1)的质量分数表达式为 。
下列关于样品组成分析的说法,正确的是 (填标号)。
A. 3时,样品中一定不含杂质
B. 越大,样品中H2C2O4•2H2O含量一定越高
C.若步骤Ⅰ中滴入KMnO4溶液不足,则测得样品中Fe元素含量偏低
D.若所用KMnO4溶液实际浓度偏低,则测得样品中Fe元素含量偏高
化合物F是合成吲哚﹣2﹣酮类药物的一种中间体,其合成路线如图:
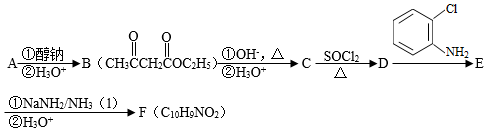
已知:Ⅰ.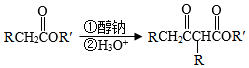
Ⅱ.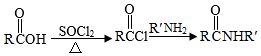
Ⅲ.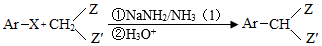
Ar为芳基;X=Cl,Br;Z或Z′=COR,CONHR,COOR等。
回答下列问题:
(1 )实验室制备A的化学方程式为 ,提高A产率的方法是 ; A的某同分异构体只有一种化学环境的碳原子,其结构简式为 。
(2)C→D的反应类型为 ; E中含氧官能团的名称为 。
(3)C的结构简式为 ,F的结构简式为 。
(4)Br2和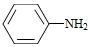 的反应与Br2和苯酚的反应类似,以
的反应与Br2和苯酚的反应类似,以 和
和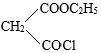 为原料合成
为原料合成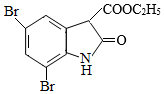 ,写出能获得更多目标产物的较优合成路线(其它试剂任选)。
,写出能获得更多目标产物的较优合成路线(其它试剂任选)。
探究CH3OH合成反应化学平衡的影响因素,有利于提高CH3OH的产率。以CO2、H2为原料合成CH3OH涉及的主要反应如下:
Ⅰ.CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H1=﹣49.5 kJ•mol﹣1
Ⅱ.CO(g)+2H2(g)⇌CH3OH(g)△H2=﹣90.4 kJ•mol﹣1
Ⅲ.CO2(g)+H2(g)⇌CO(g)+H2O(g)△H3
回答下列问题:
(1)△H3= kJ•mol﹣1。
(2)一定条件下,向体积为VL的恒容密闭容器中通入1mol CO2和3mol H2发生上述反应,达到平衡时,容器中CH3OH(g)为amol,CO为bmol,此时H2O(g)的浓度为 mol•L﹣1(用含a、b、V的代数式表示,下同),反应Ⅲ的平衡常数为 。
(3)不同压强下,按照n(CO2):n(H2)=1:3投料,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如图所示。
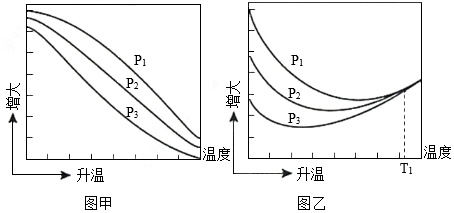
已知:CO2的平衡转化率 100%
CH3OH的平衡产率 100%
其中纵坐标表示CO2平衡转化率的是图 (填“甲”或“乙”);压强p1、p2、p3由大到小的顺序为 ;图乙中T1温度时,三条曲线几乎交于一点的原因是 。
(4 )为同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择的反应条件为 (填标号)。
A.低温、高压 B.高温、低压 C.低温、低压 D.高温、高压
CdSnAs2是一种高迁移率的新型热电材料,回答下列问题:
(1)Sn为ⅣA族元素,单质Sn与干燥Cl2反应生成SnCl4.常温常压下SnCl4为无色液体,SnCl4空间构型为 ,其固体的晶体类型为 。
(2)NH3、PH3、AsH3的沸点由高到低的顺序为 ( 填化学式,下同),还原性由强到弱的顺序为 ,键角由大到小的顺序为 。
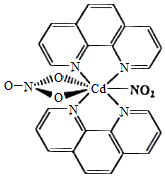
(3)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种Cd2+配合物的结构如图所示,1mol该配合物中通过螯合作用形成的配位键有 mol,该螯合物中N的杂化方式有 种。
(4)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。四方晶系CdSnAs2的晶胞结构如图所示,晶胞棱边夹角均为90°,晶胞中部分原子的分数坐标如下表所示。
坐标 原子 |
x |
y |
z |
Cd |
0 |
0 |
0 |
Sn |
0 |
0 |
0.5 |
As |
0.25 |
0.25 |
0.125 |
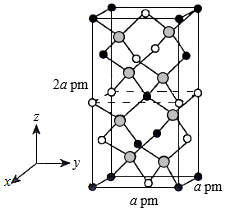
一个晶胞中有 个Sn,找出距离Cd(0,0,0)最近的Sn ( 用分数坐标表示)。CdSnAs2晶体中与单个Sn键合的As有 个。
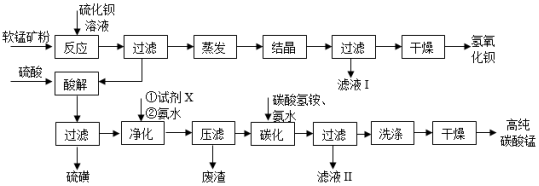
用软锰矿(主要成分为MnO2,含少量Fe3O4、Al2O3 )和BaS制备高纯MnCO3的工艺流程如图:
已知:MnO2是一种两性氧化物; 25℃时相关物质的Ksp见下表。
物质 |
Fe(OH)2 |
Fe(OH)3 |
Al(OH)3 |
Mn(OH)2 |
Ksp |
1×10﹣16.3 |
1×10﹣38.6 |
1×10﹣32.3 |
1×10﹣12.7 |
回答下列问题:
(1)软锰矿预先粉碎的目的是 ,MnO2 与BaS溶液反应转化为MnO的化学方程式为 。
(2)保持BaS投料量不变,随MnO2与BaS投料比增大,S的量达到最大值后无明显变化,而Ba(OH)2的量达到最大值后会减小,减小的原因是 。
(3)滤液Ⅰ可循环使用,应当将其导入到 操作中 (填操作单元的名称)。
(4)净化时需先加入的试剂X为 (填化学式),再使用氨水调溶液的pH,则pH的理论最小值为 (当溶液中某离子浓度c≤1.0×10﹣5mol•L﹣1时,可认为该离子沉淀完全)。
(5)碳化过程中发生反应的离子方程式为 。
在25℃时某混合溶液中c(CH3COOH)+c(CH3COONa)=0.1mol/L,lgc(CH3COOH)、lgc(CH3COO﹣)、lgc(H+)和lgc(OH﹣)随pH变化关系如图所示。Ka为CH3COOH的电离常数,下列说法正确的是( )
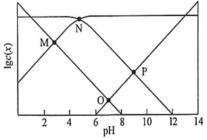
A.O点时,c(CH3COOH)=c(CH3COO﹣)
B.N点时,pH=1gKa
C.该体系中,c(CH3COOH) mol•L﹣1
D.pH由7到14的变化过程中,CH3COO﹣的水解程度始终增大
1,3﹣丁二烯与HBr发生加成反应分两步:第一步H+进攻1,3﹣丁二烯生成碳正离子( );第二步Br﹣进攻碳正离子完成1,2﹣加成或1,4﹣加成。反应进程中的能量变化如图所示。已知在0℃和40℃时,1,2﹣加成产物与1,4﹣加成产物的比例分别为70:30和15:85.下列说法正确的是( )
);第二步Br﹣进攻碳正离子完成1,2﹣加成或1,4﹣加成。反应进程中的能量变化如图所示。已知在0℃和40℃时,1,2﹣加成产物与1,4﹣加成产物的比例分别为70:30和15:85.下列说法正确的是( )
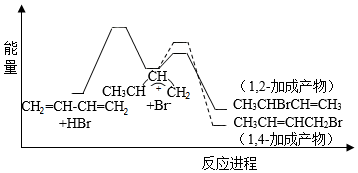
A.1,4﹣加成产物比1,2﹣加成产物稳定
B.与0℃相比,40℃时1,3﹣丁二烯的转化率增大
C.从0℃升至40℃,1,2﹣加成正反应速率增大,1,4﹣加成正反应速率减小
D.从0℃升至40℃,1,2﹣加成正反应速率的增大程度小于其逆反应速率的增大程度
采用惰性电极,以去离子水和氧气为原料通过电解法制备双氧水的装置如图所示。忽略温度变化的影响,下列说法错误的是( )

A.阳极反应为2H2O﹣4e﹣═4H++O2↑
B.电解一段时间后,阳极室的pH未变
C.电解过程中,H+由a极区向b极区迁移
D.电解一段时间后,a极生成的O2与b极反应的O2等量
α﹣氰基丙烯酸异丁酯可用作医用胶,其结构简式如图。下列关于α﹣氰基丙烯酸异丁酯的说法错误的是( )
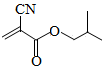
A.其分子式为C8H11NO2
B.分子中的碳原子有3种杂化方式
C.分子中可能共平面的碳原子最多为6个
D.其任一含苯环的同分异构体中至少有4种不同化学环境的氢原子
下列操作不能达到实验目的的是( )
目的 |
操作 |
|
A |
除去苯中少量的苯酚 |
加入适量NaOH溶液,振荡、静置、分液 |
B |
证明酸性:碳酸>苯酚 |
将盐酸与NaHCO3混合产生的气体直接通入苯酚钠溶液 |
C |
除去碱式滴定管胶管内的气泡 |
将尖嘴垂直向下,挤压胶管内玻璃球将气泡排出 |
D |
配制用于检验醛基的氢氧化铜悬浊液 |
向试管中加入2mL 10% NaOH溶液,再滴加数滴2% CuSO4溶液,振荡 |
A.AB.BC.CD.D
微生物脱盐电池是一种高效、经济的能源装置,利用微生物处理有机废水获得电能,同时可实现海水淡化。现以NaCl溶液模拟海水,采用惰性电极,用如图装置处理有机废水(以含CH3COO﹣的溶液为例)。下列说法错误的是( )

A.负极反应为CH3COO﹣+2H2O﹣8e﹣═2CO2↑+7H+
B.隔膜1为阳离子交换膜,隔膜2为阴离子交换膜
C.当电路中转移1mol电子时,模拟海水理论上除盐58.5g
D.电池工作一段时间后,正、负极产生气体的物质的量之比为2:1
试题篮
()