某工厂利用废硫酸溶液与铁反应制取硫酸亚铁。49t废硫酸溶液中的硫酸与5.6t铁恰好完全反应。求:
(1)废硫酸溶液中溶质的质量分数。
(2)理论上生产的硫酸亚铁的质量。[温馨提示:Fe+H2SO4═FeSO4+H2↑]
工业上制作电路的一种反应原理是Cu+2HCl+H2O2 CuCl2+2H2O.若反应了6.4g Cu,计算需要10%的H2O2溶液的质量。
“二氧化碳的实验室制取与性质”实验活动产生的废液中含稀盐酸,需先测定其溶质质量分数后进行处理。(杂质不参加反应)
(1)实验时需配制50g 5%的氢氧化钠溶液,若用氢氧化钠固体和水来配制。则需称量氢氧化钠固体的质量为 g。
(2)取20g废液样品于烧杯中,向其中逐滴加入5%的氢氧化钠溶液,恰好完全反应时共消耗氢氧化钠溶液16g。计算废液中盐酸的溶质质量分数。(写出计算过程)
(3)恰好完全反应时烧杯中的溶液所含粒子数目关系:Na+ Cl﹣. (填“>”、“=”或“<”)。
以FeSO4•7H2O为原料制备铁红(Fe2O3)的一种方法如图:

已知“沉淀”时的主要反应为:2FeSO4+H2O2+2H2O═2FeO(OH)↓+2H2SO4
(1)FeO(OH)中铁元素的化合价为 。FeO(OH)可表示为mFe2O3•nFe(OH)3, 。
(2)“沉淀”时需控制溶液的pH与反应的温度。
①“沉淀”时调节溶液的初始pH约为4,过程中应始终保持溶液的pH为3.0~4.5,需不断加入物质Z调节溶液的pH,Z应具备的性质有 (填字母)。
A.能与酸反应
B.能与碱反应
C.不与FeO(OH)反应
②“沉淀”时反应温度不宜过高,其原因是 。
(3)“过滤”后需对固体进行洗涤与干燥。洗涤时被除去的沾于固体表面的阴离子为 (填离子符号)。
(4)“煅烧”时反应的化学方程式为 。
(5)如图为其他条件相同时不同煅烧温度对产品中Fe2O3质量分数的影响。煅烧温度较低时,产品中Fe2O3质量分数较低,其原因是 。当煅烧温度达800℃时,继续升高温度,产品中Fe2O3质量分数降低,且铁元素质量分数升高,所得产品发黑,其可能原因是 。

(6)用该方法制备Fe2O3,计算理论上13.9t FeSO4•7H2O(相对分子质量为278)可制得Fe2O3的质量(写出计算过程)。
垃圾分类就是新时尚。目前,践行“新时尚”的垃圾分类工作已在全国地级及以上城市全面启动。
(1)生活垃圾可分为可回收垃圾、餐厨垃圾、有害垃圾等。
①空饮料瓶、废旧报纸应放置于贴有标志 (填字母序号,下同)的垃圾箱中。
②废旧电池中含有铅、镉、汞等有害金属,如果将其随意丢弃,这些金属渗出会造成土壤及 污染,威胁人类健康,应将其放入废旧电池专用收集箱。
③餐厨垃圾是生活垃圾的主要来源。下列有关说法合理的是 。
A.餐厨垃圾沥干水分后放入家用垃圾袋
B.部分餐厨垃圾可作为沼气池中发酵的原料
C.外出就餐提倡“光盘行动”
(2)垃圾是“放错了地方的资源”。
①部分废旧塑料具有 (选填“热塑”或“热固”)性,可反复加工再利用。
②某化学兴趣小组从工厂收集到一份金属废料,可能含有Al、Zn、Fe、Ag四种金属中的一种或几种,为测定其组成,便于回收利用,现取样向其中加入一定质量的CuSO4溶液。
Ⅰ.充分反应,得到无色溶液及少量固体剩余物,且反应前后溶液的质量相等。该金属废料中一定含有 (填元素符号)。
Ⅱ.将Ⅰ中少量固体剩余物置于试管中,加入足量稀盐酸充分反应, (选填“一定有”、“可能有”或“一定没有”) H2生成。
③建筑工地废弃的大理石边角料(主要成分为CaCO3,杂质不参加反应)可用于制备轻质碳酸钙(常用作牙膏中的摩擦剂)。已知:CaCO3 CaO+CO2↑

Ⅰ.操作a的具体步骤包括 、洗涤、干燥。
Ⅱ.计算10g大理石边角料理论上最多得到轻质碳酸钙的质量(写出计算过程)。

某同学用质量分数为15%的稀硫酸处理某造纸厂含NaOH的碱性废水样品:
(1)用9.2g质量分数为98%的浓硫酸能配制上述稀硫酸 g(计算结果保留整数)。
(2)若上述造纸厂废水75g能与9.8g 15%的稀硫酸恰好反应(设只发生NaOH与硫酸的反应),试计算该废水中NaOH的质量分数(写出计算过程,结果精确到0.1%)。
CO2是最主要的温室气体,也是巨大的碳资源,CO2的低能耗捕集、转化和利用正受到世界各国的广泛关注。
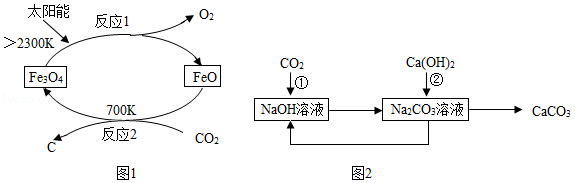
(1)以CO2为原料制取炭黑的太阳能工艺如图1所示。
①反应1的基本类型为 。
②反应2中碳元素的化合价 (填“升高”“不变”或“降低”)。
(2)利用NaOH溶液吸收CO2,部分转化关系见图2。
反应①的化学方程式为 ,该转化中循环使用的物质是 。
(3)利用Na2CO3或K2CO3溶液吸收低浓度的CO2,将其转化为NaHCO3或KHCO3,NaHCO3或KHCO3受热分解生成高浓度的CO2储存利用,生成的Na2CO3或K2CO3循环使用以降低生产成本。
吸收剂 |
Na2CO3 |
K2CO3 |
20℃最高浓度(g/L) |
212 |
1104 |
价格(元/Kg) |
1.25 |
9.80 |
根据表中信息,选择K2CO3溶液作吸收液的优点是 。
(4)利用一种新型“人造树叶”将CO2转化为乙醇(C2H5OH)的反应如下:2CO2+3H2O C2H5OH+3O2,研究显示,1L“人造树叶”每天能从空气中吸收968g CO2,计算1L“人造树叶”工作1天可得到乙醇的质量(写出计算过程)。
(5)某研究小组设计如图3所示实验,探究CO2和H2在一定条件下反应的产物。
查阅资料:①CO2和H2在合适催化剂和一定温度下反应转化为CO和H2O;
②白色无水硫酸铜吸水后变为蓝色。
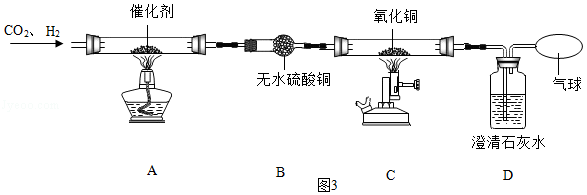
实验过程中观察到的主要现象有:B装置中白色固体变为蓝色,C装置中黑色固体变为红色,D装置中澄清石灰水变浑浊。
①设计B装置的目的是 。
②C装置中发生的反应的化学方程式为 。
③研究小组反思后认为,根据上述实验现象不能确认CO2和H2反应生成了CO,理由是 。
硼及其化合物在现代工农业、医学、国防中有着重要的应用价值。利用硼镁矿可制备硼,工艺流程如图所示。请回答下列问题:

(1)B2O3中B元素的化合价为 。
(2)为加快硼镁矿石与浓NaOH溶液的反应速率,可采取的措施是 ;回收副产物Mg(OH)2可制得流程 的反应物。
(3)H3BO3加热分解只生成两种氧化物,流程②的化学反应方程式为 。
(4)根据流程③的化学反应方程式:B2O3+3Mg 2B+3MgO,理论上制备1.1吨的硼,需消耗镁多少吨写出计算过程)?
钢铁的腐蚀是重要研究课题。
[知识回顾]用如图1所示实验进行铁钉腐蚀的研究。一段时间后试管A、B中铁钉几乎没有生锈,而试管C中铁钉明显锈蚀,试管D、E中铁钉严重锈蚀。

(1)由A、B、C的现象可知,铁的锈蚀是铁跟 (填化学式)等物质作用的过程。
(2)试管B中使用“煮沸并迅速冷却的蒸馏水”,其目的是 。
[实验探究]向试管D中(含生锈铁钉)加入过量10%稀盐酸,浸泡。可观察到铁锈逐渐消失,铁钉表面有气泡产生,溶液呈黄色,一段时间后黄色变为浅绿色。
(3)写出铁锈溶于盐酸的化学方程式: 。
(4)推测试管D中溶液由黄色变为浅绿色,可能是因为氯化铁与某些物质发生反应所致。现进行如表3个实验(持续10小时,已知氢气不影响该反应)
序号 |
实验Ⅰ |
实验Ⅱ |
实验Ⅲ |
实验内容 |
|
|
|
现象 |
溶液颜色始终呈黄色 |
产生红褐色沉淀 |
溶液逐渐由黄色变浅绿色 |
①设计实验Ⅰ的目的是 。
②综合分析上述3个实验,试管D中溶液由黄色变为浅绿色的原因是 。
[拓展延伸]研究水样的pH、水中溶解氧浓度与钢铁腐蚀速率的关系。查阅相关文献得到如下资料。

(5)图2表示水样温度22℃、氧含量6mL•L﹣1时,钢铁腐蚀速率与水样pH的关系。当pH<4时,钢铁腐蚀速率明显增大的原因是 。
(6)图3表示温度22℃、pH=7时,钢铁腐蚀速率与水中溶解氧浓度的关系。当溶解氧超过20mL•L﹣1时,钢铁腐蚀速率明显下降的原因可能是 。
南通滨临长江,将长江水净化处理可成为居民生活用水。
(1)水净化时先加入絮凝剂,沉降过滤后,通过活性炭。活性炭的作用是 。
(2)将硬水通过如图所示的阳离子交换柱后可变成软水(图中阴离子未画出),交换后的水仍然呈电中性。
①一个Ca2+可以交换出 个Na+。
②阳离子交换柱长时间使用后,Na+变少,失去硬水软化功能而失效。利用生活中常见物质检验阳离子交换柱已失效的方法是 。
(3)二氧化氯(ClO2)可用于饮用水的杀菌消毒。取100mL经ClO2消毒后的饮用水于锥形瓶中,调节溶液至弱碱性,加入足量KI充分反应,测得生成I2的质量为0.0254mg。上述过程中发生的反应为2ClO2+2KI═2KClO2+I2,其他物质不参与反应。计算该饮用水中ClO2的残留量(以mg/L计),在答题卡上写出计算过程。

溶液在生产、生活中起着十分重要的作用。某学习小组的同学对溶液的性质进行探究。
[引发思考]
生理盐水是医疗上常用的一种溶液,100mL生理盐水(其密度可近似看做lg/cm3)中含有0.9g医用氯化钠,该溶液中溶质的质量分数为 。一瓶合格的生理盐水密封放置一段时间后,不会出现浑浊现象,原因是 。
[提出问题]
溶液的某些性质是否可以通过定量实验进行验证?
[查阅资料]
电导率传感器用于测量溶液的导电性强弱:一定条件下,电导率的大小能反映离子浓度的大小。
[实验探究1]
氯化钠溶于水形成溶液的过程中氯离子浓度电导率的测定。
第一步:读取室温为26℃,取100mL蒸馏水,加入烧杯中,放入磁力搅拌器磁珠;
第二步:校准传感器,组装仪器,设定搅拌档位;
第三步:用氯离子传感器和电导率传感器同时采集数据,迅速将定质量的氯化钠加入烧杯中。实验数据如图1所示。

分析图1实验数据:
(1)a~b段曲线呈这种形态的原因是 。
(2)请说明实验过程中液体的电导率变化的原因 。
[交流反思1]
如何通过实验验证氯化钠溶液是均一的?请简要说明。 。
[实验探究2]用氯离子传感器和电导率传感器同时采集数据,向一定体积、一定浓度的氯化钠溶液中慢慢加入等体积、一定浓度的硝酸银溶液,恰好完全反应。部分实验数据如图2所示。
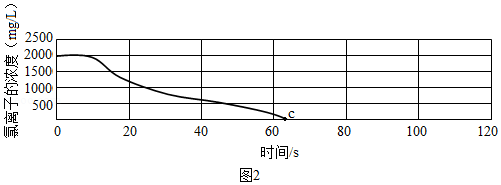
[交流反思2]
推测c点时溶液的电导率是否为零,并说明理由。 。
中和反应是化学核心概念之一。某化学兴趣小组对中和反应展开了探究。
[实验目的]证明氢氧化钠溶液与盐酸发生化学反应。
[实验步骤]
步骤一:取一定量稀氢氧化钠溶液于烧杯中,滴加2滴酚酞试液,溶液呈红色。
步骤二:用仪器A吸取稀盐酸向烧杯中逐滴加入,边滴加边用玻璃棒搅拌,红色变浅直至消失。
步骤三:向溶液中继续滴加稀盐酸至溶液呈酸性,用玻璃棒蘸取其中溶液,在酒精灯上加热至蒸干,有白色固体产生。
[思考拓展]
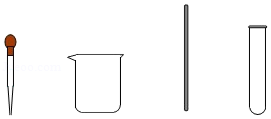
(1)从下列仪器中选择步骤二中的“仪器A”,名称是 。
(2)兴趣小组认为仅从上述步骤二的现象,难以证明盐酸与氢氧化钠发生了反应。
查阅资料:(i)酚酞试液在不同的pH时变化情况如下:
pH |
0~8.2 |
8.2~10.0 |
10.0~14.0 |
颜色 |
无色 |
粉红色 |
红色 |
(ⅱ)氢氧化钠溶液的pH随浓度的降低而减小。
兴趣小组据此形成了对比实验方案以排除干扰,该对比实验方案是 。
(2)为确认步骤三中的白色固体是氯化钠而不是氢氧化钠,进行如下实验:
步骤 |
现象 |
结论 |
|
将白色固体溶于水形成溶液,均分成两等份 |
向其中一份滴加CuSO4溶液,振荡、静置 |
①无 色沉淀生成 |
白色固体不是NaOH. |
向另一份滴加AgNO3溶液,振荡、静置 |
出现白色沉淀 |
②白色固体是NaCl,反应的化学方程式为 。 |
|
[继续探究]
(4)图1是氢氧化钠与盐酸反应的微观示意图。从微观角度分析,氢氧化钠溶液和盐酸反应的实质是 。
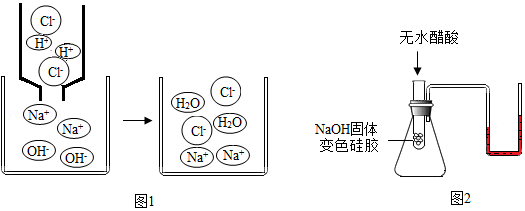
(5)兴趣小组认为上述实验对反应实质缺少直观的验证。
査阅资料:(ⅲ)变色硅胶为蓝色,吸水后呈红色。(ⅳ)变色硅胶与NaOH固体充分混合,无明显现象;变色硅胶与无水醋酸(CH3COOH)充分混合,无明显现象。
兴趣小组据此设计了图2实验,验证中和反应有水生成:将无水醋酸迅速倒入装有NaOH固体和变色硅胶的试管中,并用玻璃棒在试管中不断搅拌,观察到变色硅胶由蓝色逐渐变为红色,U型管内液面左低右高。
①U型管内液面左低右高说明该反应 热量(填写“放出”或“吸收”)。
②无水醋酸由CH3COO﹣和H+构成。变色硅胶由蓝色变成红色的原因是 (用化学方程式表示)。
我国塑料购物袋的年消耗量很大,废弃塑料的处理亟待解决。回答下列问题。
(1)购物袋等塑料制品的大量使用,可能会造成的一种环境污染是 。
(2)小林尝试用焚烧法对某类塑料购物袋(主要成分是聚氯乙烯)进行处理,并将燃烧产物用氢氧化钠溶液进行吸收。
【查阅资料】Ⅰ.聚氯乙烯的化学式为(C2H3Cl)n。
Ⅱ.氯化氢气体会污染环境
Ⅲ.Na2CO3+CaCl2═CaCO3↓+2NaCl
①聚氯乙烯完全燃烧的化学方程式如下:
2(C2H3Cl)n+5nO2 4nCO2+2nHCl+2nX,则X的化学式为 。
②将完全燃烧后的产物,全部通入到一定量的NaOH溶液中,得到吸收液,写出氢氧化钠溶液吸收氯化氢的化学方程式 。
③小林对吸收液的溶质成分产生了兴趣,进行如下探究:
[提出问题]吸收液中溶质的成分是什么?
[进行实验1]取吸收液少许置于试管中,滴加2~3滴无色酚酞试液,发现酚酞变红色,说明溶液呈 性。
[猜想]猜想1:NaCl、NaOH、Na2CO3
猜想2:
猜想3:NaCl、Na2CO3、NaHCO3
猜想4:NaCl、NaHCO3
[进行实验2]向实验1所得溶液中,加入过量的CaCl2溶液,小林观察到 (填实验现象),最终得出结论:猜想1正确。
[交流反思]实验结束后,小林对吸收液进行无害化处理,其方案是 ,然后倒入废液缸。
咨询老师后,小林获悉废弃塑料的资源化回收是减少环境危害的最好方法。
(3)聚氯乙烯的生产需要用到氯气。工业上获取氯气的方法是电解饱和食盐水,发生反应的化学方程式为:2NaCl+2H2O 2NaOH+H2↑+Cl2↑.某工厂需生产14.2t氯气(Cl2),至少需要氯化钠的质量为多少?(请写出计算过程)
化学兴趣小组对“可乐除铁锈”实验展开探究。同学们将几枚生锈的铁钉放入某品牌的可乐中,观察到铁钉表面有气泡产生,容器底部沉有固体物质。取出铁钉后用水清洗,铁钉恢复光亮。
Ⅰ.容器底部固体成分探究。
【实验探究1】取出容器底部剩余的固体物质,用水清洗后干燥,分成甲、乙两份备用。
实验操作 |
实验现象 |
解释与结论 |
①用磁铁靠近固体物质甲 |
固体物质 (填“能”或“不能”)被吸引 |
固体物质中不含铁单质 |
②将固体物质甲放入20%的盐酸中 |
固体逐渐消失,溶液变成黄色 |
固体物质主要是氧化铁,化学反应方程式为 。 |
Ⅱ.溶液中逸出气体成分探究。
【猜想假设】气体中除了可乐本身含有的CO2外,可能还有H2。
【查阅资料】①H2可以还原CuO,生成Cu和H2O。
②无水硫酸铜为白色固体,遇水变蓝。
【实验探究2】将逸出气体依次通过如图的组合装置。

(1)NaOH溶液的作用是 。
(2)实验过程中观察到 现象,证明逸出气体中含有氢气。
Ⅲ.深入探究
【提出问题】铁钉表面已变光亮,而容器底部有大量铁锈剩余的原因是什么?
【猜想假设】①可乐太少,酸性物质量不足。②可乐酸性弱,与铁锈反应太慢。
【实验探究3】取可乐与锈铁钉反应后的剩余液,测得溶液仍然呈酸性,猜想①不成立。
【查阅资料】3%的稀盐酸pH约为1,某品牌可乐的pH值为3.39.质量分数为3%的稀盐酸比该品牌可乐的酸性 (选填“弱”或“强”)。
【实验探究4】取另一份固体物质乙放入3%的稀盐酸中,振荡,观察无明显现象。
【实验结论】对比【实验探究1】和【实验探究4】的不同反应现象可得出:化学反应速率与反应物的 有关。猜想②成立。
【合理推测】可乐能快速去除铁钉表面铁锈的真正原因是:铁锈结构疏松多孔, 。
Ⅳ.废液处理
将【实验探究1】和【实验探究4】中废液混合,得到澄清溶液100.0g,通过氯离子检测仪测得氯离子质量分数为7.1%.从环保角度考虑,最好在废液中加入 g氢氧化钠固体,充分反应,过滤后再将废液排放。
试题篮
()