我国重载铁路加氢站今年投入了商业运营。机车加注 80kg氢气做燃料,若用电解水的方法制取这些氢气,理论上需要水的质量是多少?(写出计算过程)
某兴趣小组用如图所示装置制取 O2,加热混合物至不再产生气体后,称量试管中剩余固体的质量为 20.0g。请计算:
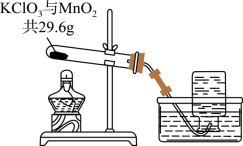
(1)生成 O2的质量为_____ g。
(2)剩余固体中 KCl的质量分数。
化学兴趣小组对钢铁厂生产出来的某产品(只含铁和碳)产生好奇:它是生铁还是钢?该小组取 5.7g样品,加入到盛有足量稀硫酸的烧杯中,实验得到氢气的质量如下表。(提示:生铁的含碳量为 2%~4.3%,钢的含碳量为 0.03%-2%)
|
时间/min |
0 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
质量/g |
0 |
0.06 |
0.1 |
0.15 |
0.18 |
0.20 |
0.22 |
0.20 |
0.20 |
(1)分析判断:表格中第_____分钟的数据不合理;
(2)根据表格中合理的数据,在给出的坐标系上,画出氢气质量与时间的关系曲线:
(3)通过计算判断该产品是生铁还是钢?(写出计算过程,计算结果保留到 0.1%)
某小组采用图a所示实验装置探究 CO还原 Fe2O3时,出现了争论。甲同学观察到固体由红色变成黑色,推断黑色固体是 Fe;乙同学提出质疑,认为黑色固体可能是 Fe3O4,并查阅了资料: Fe3O4可被磁铁吸引,几乎不溶于稀的酸溶液。
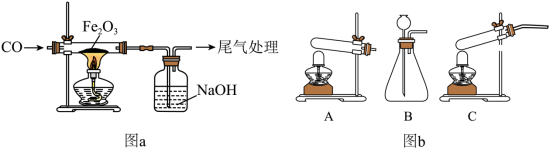
(1)制备
CO的原理是: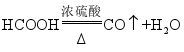 (
HCOOH在常温下为液态),图b所示三种气体发生装置中,可用于制备
CO的是______(填标号)。
(
HCOOH在常温下为液态),图b所示三种气体发生装置中,可用于制备
CO的是______(填标号)。
(2)若甲同学推断正确,反应的化学方程式为______。
(3)对乙同学提出的质疑进行分析和验证。
①定量分析物质组成可知,该反应生成 Fe3O4是合理的,理由是______。
②该小组通过对黑色固体进行检验,证明同时含有 Fe3O4和 Fe.检验的操作和现象是:取样于试管中,______。
(4)该小组为了探索 CO还原 Fe2O3与温度的关系,走访了某钢铁厂。工程师用SDTQ热分析仪对该反应进行研究,根据不同温度下所得固体的质量,推导对应的固体成分,结果如图。
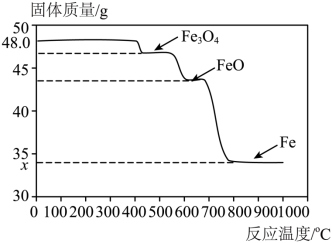
①用 CO炼铁时,还原 Fe2O3的温度应不低于______ ℃。(填“ 400”“ 600”或“ 800”)
②图中: x=______。
③该小组查阅资料得知酒精灯加热温度为
600℃左右,他们发现上述对黑色固体成分的检验结果与图像有矛盾,推测黑色固体在冷却过程中发生了以下反应:______ ______。
______。
定性实验和定量实验是化学中常见的两种实验方法。
(1)铝和氧气生成致密的______。
(2)打磨后的铝丝放入硫酸铜溶液中发生反应,出现的反应现象:______。
(3)如图是探究白磷燃烧条件的图像:
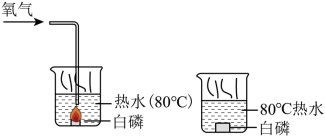
从图中得知白磷燃烧的条件是______。
(4)某同学向相同体积的 5%H2O2分别加入氧化铁和二氧化锰做催化剂,现象如下表:
|
催化剂 |
现象 |
|
MnO2 |
有大量气泡 |
|
Fe2O3 |
少量气泡 |
根据气泡生成多少可以得到什么化学启示:______。
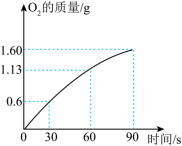
(5)某同学在 H2O2溶液中加入 MnO2做催化剂时,反应生成气体的质量与时间的关系如图所示,求反应 90s时消耗 H2O2的质量。(写出计算过程)
羰基铁粉在国防军工领域有重要应用,我国是少数几个掌握其生产技术的国家之一。制备羰基铁粉的过程如图所示。

(1) Fe(CO)5中碳、氧元素的质量比为___________。
(2)反应1的化学方程式为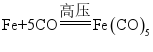 。用
100kg含铁
96%的海绵铁,理论上可制备
Fe(CO)5的质量是多少?(写出计算过程)
。用
100kg含铁
96%的海绵铁,理论上可制备
Fe(CO)5的质量是多少?(写出计算过程)
(3)反应2的化学方程式为 。
196kgFe(CO)5分解生成基铁粉的质量随时间的变化如下图所示。在
t1时,剩余 _____
kgFe(CO)5未分解;在___________时
Fe(CO)5恰好完全分解。
。
196kgFe(CO)5分解生成基铁粉的质量随时间的变化如下图所示。在
t1时,剩余 _____
kgFe(CO)5未分解;在___________时
Fe(CO)5恰好完全分解。
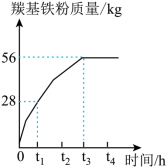
(4)制备羰基铁粉过程中循环利用的物质是______ 。
根据
Fe3O4+4CO 3Fe+4CO2反应原理,工业上可用来冶炼铁。现用
100t含四氧化三铁为
46.4%的某铁矿石冶炼金属铁。请完成下列问题,写出必要的计算过程。
3Fe+4CO2反应原理,工业上可用来冶炼铁。现用
100t含四氧化三铁为
46.4%的某铁矿石冶炼金属铁。请完成下列问题,写出必要的计算过程。
(1)该铁矿石中含四氧化三铁质量是多少?
(2)理论上可炼出含铁 96%的生铁的质量是多少?
(1)用 100克溶质质量分数为 30%的过氧化氢溶液配制成溶质质量分数为 5%的过氧化氢溶液,需加水_____克。
(2)取 75克某过氧化氢溶液放入锥形瓶中并加入一定量的二氧化锰,用电子秤测其质量,不同时间电子秤的读数如下表所示。试计算该过氧化氢溶液的溶质质量分数(不考虑 H2O逸出,写出计算过程,结果保留到 0.1%)。
反应时间/ min |
0 |
1 |
2 |
3 |
4 |
5 |
6 |
锥形瓶+瓶内物质的总质量/ g |
375.00 |
371.56 |
366.28 |
365.56 |
365.40 |
365.40 |
365.40 |
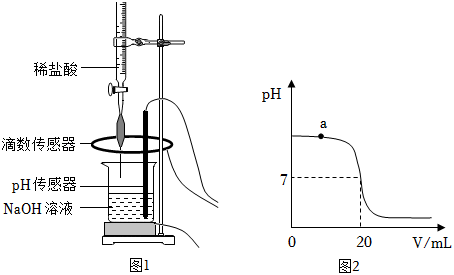
化学兴趣小组利用中和反应测定某 NaOH溶液的浓度,实验过程如下:
(1)配制稀盐酸:取 10g36.5%的浓盐酸,加水稀释成 1000mL的稀盐酸。所得稀盐酸中溶质的质量为_____;
(2)常温下,测定 NaOH溶液浓度:
Ⅰ.取 20g待测 NaOH溶液于烧杯中,按图1所示将上述稀盐酸滴入,通过数字化传感器同时测定滴入烧杯内盐酸的体积和烧杯内溶液的 pH,得到如图2所示曲线。
Ⅱ.当 NaOH溶液与稀盐酸恰好完全反应时,所得溶液的 pH为_____。经计算,此时已滴入烧杯内的稀盐酸中,所含溶质的质量为 0.073g。
设 20gNaOH溶液中溶质的质量为 x。
NaOH+HCl=NaCl+H2O
4036.5
x0.073g
列出比例式__________
求解 x=0.08g
答: 20gNaOH溶液中溶质的质量分数为 __________(列式并计算结果);
(3)写出a点对应的溶液中大量存在的分子、离子__________(用化学符号表示)。
游览活动即将结束,化学精灵请同学们乘坐氢燃料汽车回家。氢气作为燃料具有热值高、无污染的优点,但是制备成本高,储存有难度。若用废旧黄铜( Cu﹣Zn合金)和稀硫酸为原料制备氢气,测得实验数据如图,请计算:
(1)该废旧黄铜中锌的质量为_____ g。
(2)实验中生成氢气的质量。

夏日鱼塘缺氧,鱼类“浮头”现象多发。养鱼师傅向鱼塘中撒入一种主要成分为过氧化钙( CaO2)的白色固体(杂质不与水反应),以解决鱼塘缺氧问题。
(1)影响气体溶解度的外界因素有_____。过氧化钙与水反应生成氢氧化钙和氧气,氢氧化钙对水产养殖颇有益处,列举一项__________。
(2)将 CaO2质量分数为 60%的白色固体 180g撒入鱼塘,产生氧气(密度为 1.43g/L)的体积是多少?(写出计算过程)
2022年我国将有6名航天员生活在空间站。氧气、水、食物等是维持航天员驻留空间站的必要物质。为提高物质的利用率,目前空间站通过以下途径实现物质循环利用:
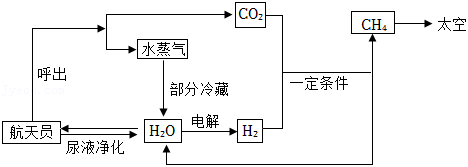
(1)由图可知,目前空间站通过物质循环获得水的途径共有_____条,其中尿液净化时必须除去尿液中的__________等代谢废物。
(2)为实现氧的循环,目前空间站内利用氢气和航天员呼出的二氧化碳,在一定条件下转化为甲烷和水,化学方程式为
4H2+CO2 2H2O+CH4。据测算,正常情况下一位航天员一天呼出的二氧化碳质量约
1.1千克,若这些二氧化碳全部与氢气反应,则可生成水多少千克?
2H2O+CH4。据测算,正常情况下一位航天员一天呼出的二氧化碳质量约
1.1千克,若这些二氧化碳全部与氢气反应,则可生成水多少千克?
铝碳酸镁咀嚼片(主要成分是 AlMg(OH)3CO3)可治疗胃酸过多症,反应原理可用化学方程式表示为 AlMg(OH)3CO3+5HCl═MgCl2+AlCl3+4H2O+CO2↑。某化学兴趣小组使用如图所示装置,对该咀嚼片中的铝碳酸镁含量进行测定。先取足量稀盐酸于烧杯中,再向其中加入 20片铝碳酸镁咀嚼片,开始计时,并将电子天平的读数记录在下表中。已知 AlMg(OH)3CO3的相对分子质量为 162。请计算:
时间( s) |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
读数( g) |
198.4 |
197.8 |
197.4 |
196.0 |
195.8 |
195.7 |
195.7 |
195.7 |
(1)生成二氧化碳_____ g。
(2)每片该咀嚼片中铝碳酸镁的含量为多少(计算结果保留到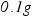 )?
)?

某同学在学习质量守恒定律时,称取 0.6g镁条进行燃烧实验(如图)。
(1)计算:镁条完全燃烧生成氧化镁的质量(写出计算过程)。
(2)该同学称得反应后固体的质量小于 0.6g,原因可能是_____。
铝碳酸镁咀嚼片(主要成分是 AlMg(OH)3CO3)可治疗胃酸过多症,反应原理可用化学方程式表示为 AlMg(OH)3CO3+5HCl═MgCl2+AlCl3+4H2O+CO2↑。某化学兴趣小组使用如图所示装置,对该咀嚼片中的铝碳酸镁含量进行测定。先取足量稀盐酸于烧杯中,再向其中加入 20片铝碳酸镁咀嚼片,开始计时,并将电子天平的读数记录在下表中。已知 AlMg(OH)3CO3的相对分子质量为 162。请计算:
时间( s) |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
读数( g) |
198.4 |
197.8 |
197.4 |
196.0 |
195.8 |
195.7 |
195.7 |
195.7 |
(1)生成二氧化碳____ g。
(2)每片该咀嚼片中铝碳酸镁的含量为多少(计算结果保留到 0.1g)?

试题篮
()