A、B、C、D、E、F六种物质都是初中化学内容中涉及的化合物,转化关系如下图,其中D是最常见的溶剂。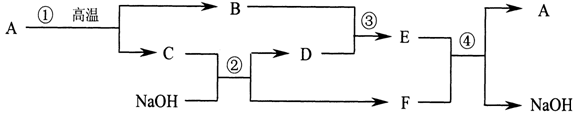
(1)根据上图推断,A是 ,D是 ,E是 (填写化学式)
(2)写出反应④的化学方程式: 。
某纯碱样品中混有少量的氯化钠,为了测定样品的纯度,小明做了如下实验:准确称取样品11.2g,向其中加入93.2 g稀盐酸,恰好完全反应,共产生气体4.4g,请回答下列问题:(结果精确到0.1%)
(1)纯碱样品中的Na2CO3的质量分数是多少?
(2)反应后所得溶液中溶质的质量分数是多少?
如下图,A、B、C、D、E各代表铁、水、二氧化碳、硫酸铜溶液、氢氧化钠溶液中的一种物质。常温下,相连环物质间能发生反应,不相连环物质间不能发生反应,且B的相对分子质量大于D。请填空: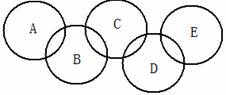
(1)写出下列物质的化学式:A ,D 。
(2)写出B与C反应的方程式 。
(3)相连环物质间发生的反应,没有涉及的基本反应类型是___ _ _。
(6分)实验室有一氯化钠和氯化钙组成的样品。为测定其中氯化钠的纯度并配制成一定溶质质量分数的溶液,某化学探究小组取一定质量的该样品进行如下实验。
请回答下列问题: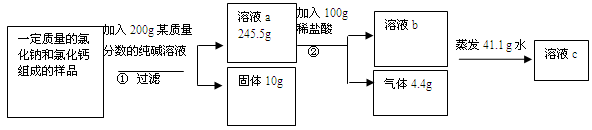
(1)写出反应②的化学方程式 ;
(2)根据已知条件列出求解①中参加反应的纯碱质量(X)的比例式
(3)该样品中氯化钠的质量分数为 ;
(4)若用36.5%的浓盐酸配制上述恰好完全反应的稀盐酸,需加水的体积为 mL;
(5)若最终所得的c溶液为只含一种溶质的不饱和溶液,则c溶液中溶质的质量分数为 ;
(6)若工业上用58.5t上述含氯化钠的样品为原料来制取氢氧化钠,可制得氢氧化钠的质量为 。
称取NaOH 和 Ba(OH)2 的固体混合物21.3g,加入100g蒸馏水,完全溶解后向该混合溶液中逐滴加入质量分数为10%的Na2SO4溶液,反应生成BaSO4沉淀的质量与所加入的Na2SO4溶液的质量关系如下图所示。试回答下列问题: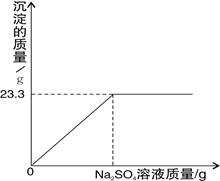
(1)完全反应后生成BaSO4沉淀 g。
(2)恰好完全反应时消耗Na2SO4溶液的质量是多少克?
(3)恰好完全反应时所得溶液中溶质的质量分数是多少?
(精确到0.1%)
实验室有一包固体混合物,其中可能含有Cu(OH)2、CuO、NaOH、Fe、Na2CO3、CaCl2六种物质中的两种或多种。按下图所示进行实验,出现的现象如图中所述。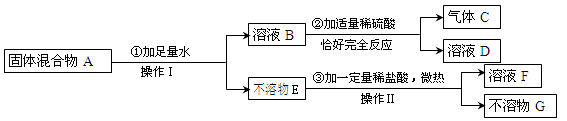
试根据实验过程和发生的现象判断:
(1)操作Ⅰ和操作Ⅱ的名称是 ,该操作用到的玻璃仪器有 、漏斗和烧杯。
(2)产生的气体C是 (写化学式,下同)。
(3)不溶物G显红色,则溶液F中一定含有的溶质是 。
(4)由以上可知:固体混合物A中,一定存在的物质是 ;写出过程③中肯定发生的化学反应方程式: (写一个即可)
(一)实验室有一瓶标签如图所示的浓盐酸,要配制200g7.3%的盐酸,需要用该盐酸多少毫升?
(二)某校化学兴趣小组用所配制的稀盐酸,测定该某矿山上的石灰石样品中碳酸钙的质量分数,假设矿石中只含杂质二氧化硅(二氧化硅是一种极难溶于水也不与盐酸反应且耐高温的固体),他们取一块,将其粉碎后,称出11g放入烧杯内(烧杯的质量为20g), 然后加入100g所配制的稀盐酸,用玻璃棒搅拌至不再产生气泡为止,二者恰好完全反应,得到下列数据,请分析表格中的数据,回答下列问题。
| |
反应前 |
反应后 |
|
| 实验 数据 |
烧杯和石灰石质量 |
加入盐酸质量 |
反应后混合物质量 |
| 31g |
100g |
126.6g |
(1)生成二氧化碳的质量为多少?
(2)此石灰石样品碳酸钙的质量分数为多少;
(3)将反应后混合物过滤,将滤液蒸发掉多少克水后可得到某温度下氯化钙的饱和溶液(某温度下,氯化钙的溶解度为25克)(计算结果保留一位小数)
(4)若某石灰厂在矿山上开采出这样的矿石550吨,最后可得含杂质的生石灰多少吨?
实验室有一瓶长期暴露在空气中的氢氧化钠固体样品,观察发现,样品表面有白色粉末。某兴趣小组的同学对该样品的成分及含量进行了探究。
【提出问题1】该样品中含有那些物质?
【提出猜想】通过分析,提出如下猜想:
猜想Ⅰ:全部是NaOH 猜想Ⅱ:已完全变质,该样品中只含Na2CO3;
猜想Ⅲ:部分变质,该样品中含有 ① 。
【查阅资料】CO2在饱和碳酸氢钠溶液中几乎不溶解。
【实验探究1】为确定该样品的成分,小明设计了如下实验方案,请你一起完成下列实验报告。
| 实验操作 |
实验现象 |
实验结论 |
| 1)取少量样品溶于水,加入 ② |
白色沉淀产生 |
该反应的化学方程式:③ 氢氧化钠已经变质 |
| 2)将上述反应后的混合物过滤,取滤液加入④ |
⑤ |
证明猜想Ⅲ正确 |
回答下列问题
(1)实验室中,氢氧化钠固体应怎样保存? ⑥
(2)用酚酞试液 ⑦ (填“能”或“不能”)检验氢氧化钠变质。
(3)若取少量的固体溶于水, 滴加几滴稀盐酸,没有气泡产生。__⑧___(填“能”或“不能”)证明氢氧化钠固体没有变质。
【提出问题2】如何测量该部分变质样品中碳酸钠的质量分数?
【实验探究2】小红同学设计如图所示装置(铁架台略去),实验在20℃,101kPa下进行,步骤如下: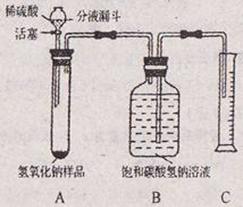
①按图连接好装置;
②检查装置气密性
③用托盘天平准确称取该样品2g,放入A中试管内,向B中集气瓶中倒入饱和碳酸氢钠溶液至瓶颈处;
④向分液漏斗中加入稀硫酸,打开活塞,让稀硫酸滴入试管中至过量,关闭活塞。反应结束后,量筒中收集到饱和碳酸氢钠溶液224mL。
请回答下列问题:
(1)B中集气瓶盛放的饱和碳酸氢钠溶液不能用水代替,其理由 ⑨
(2)试管中原有的空气对实验结果没有明显影响理由是 ⑩
(3)变质氢氧化钠样品中碳酸钠的质量分数为 ⑪ (20℃,101kPa下,22.4L二氧化碳的质量为44g)
【拓展提高】已知Na2CO3溶液与稀硫酸反应先生成NaHCO3,当Na2CO3全部转化为NaHCO3后,生成的NaHCO3能继续与稀硫酸反应生成CO2。现向样品中加一定量的稀硫酸,反应后产生无色气体并得到X溶液。请分析推断反应后所得X溶液的溶质,其所有的可能组成Na2SO4和NaHCO3、 ⑫ 、 。
下列根据实验操作所绘制的图象中,不正确的是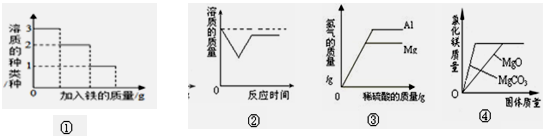
| A.图①向一定量的AgNO3 Cu(NO3)2 Fe(NO3)2混合溶液中加入铁粉 |
| B.图②是向室温下的饱和石灰水中加入生石灰,溶液中的溶质质量与时间的关系 |
| C.图③是向等质量的金属镁和铝中加入足量且质量分数相等的稀硫酸,生成氢气的质量与加入稀硫酸质量的关系 |
| D.图④是分别向同质量、同质量分数的稀盐酸中不断加入碳酸镁和氧化镁固体,加入固体质量与生成氯化镁的质量关系 |
下图是某兴趣小组设计的四个实验装置,其中实验不能够成功的是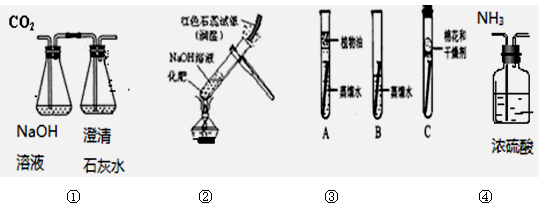

| A.实验①证明CO2能与NaOH溶液反应 |
| B.实验②鉴别化肥为铵态氮肥 |
| C.实验③探究铁生锈的两个条件 |
| D.实验④用浓硫酸干燥氨气 |
将质量相等的A、B、C三种金属,同时分别放入三份质量分数相同且足量的的稀盐酸中,反应生成的H2质量与时间关系如图,得出结论正确的是(已知A、B、C在生成物中均为+2价)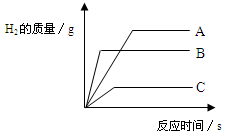
A.金属的活动性顺序A﹥B﹥C
B.生成H2的质量C﹥B﹥A
C.相对原子质量C﹥B﹥A
D.反应速率最大的是A
柠檬酸(C6H8O7)是一种工业原料,广泛应用于食品、医药等行业。如图是两种不同方法制备一水柠檬酸晶体(C6H8O7·H2O)的工艺流程图。回答相关问题:
【资料卡片】
①柠檬酸水溶液显酸性;
②工业生产柠檬酸,原料预处理后,得到的发酵液中含有柠檬酸及其他可溶性杂质;
③一水柠檬酸在不同温度下的溶解度如下表:
| 温度/℃ |
0 |
10 |
20 |
30 |
40 |
|
| 溶解度/g |
96 |
118 |
146 |
183 |
216 |
|
④某种专用树脂对柠檬酸的吸附率和水温的关系如图:
【钙盐法制备】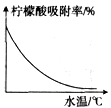
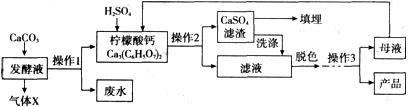
(1)气体X是____(填化学式),实验室检验该气体的化学方程式为________________;
(2)在发酵液中加入CaCO3,同时升温至90℃,这样做的目的是____________ ;
(3)加入硫酸反应的化学方程式为____,是____(填基本反应类型)反应;
(4)操作l、2的名称是____,实验室完成此操作,所需的玻璃仪器有____(填字母序号)及玻璃棒;
(5)操作3的目的是得到一水柠檬酸晶体,操作顺序是b→____→a;
a.过滤 b.加热浓缩 c.冷却结晶 d.蒸发结晶
(6)工业生产中,可加入____(填名称)进行脱色处理;
(7)洗涤CaSO4滤渣的目的是____;
(8)母液可以循环,其中一定含有的溶质是____;
【变温色谱分离法制备】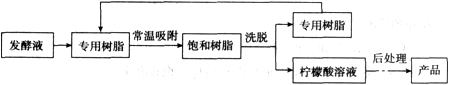
(9)洗脱的目的是使专用树脂再生,根据资料,洗脱操作适宜用____;
(10)对比“变温色谱分离法”“钙盐法”的劣势除了消耗资源,请列举破坏环境的两个方面:____、____。
通过实验对草酸(相对分子质量是90)进行如下研究。
【查阅资料】①浓硫酸常作干燥剂 ②浓NaOH溶液常用于吸收CO2气体
③无水硫酸铜吸水后由白色变为蓝色 ④氯化钯(PdCl2)溶液遇CO产生黑色沉淀
【实验准备】选用下列实验装置(气密性良好,部分固定装置已略去):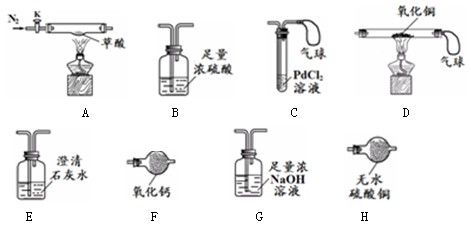
【实验I】检验草酸分解的产物。
| 实验步骤 |
实验现象 |
实验结论及分析 |
| (1)按A→H→E→C 连接仪器 (2)关闭K,点燃A处酒精灯 |
H中 E中澄清石灰水变浑浊 C中产生黑色沉淀,气球鼓起 |
草酸分解生成了CO2、CO和H2O ①E中反应的化学方程式是 ②C中气球的作用是 |
【实验II】取9 g草酸进行实验,测定生成物的质量并确定草酸的组成。
| 实验步骤 |
实验数据 |
实验结论及分析 |
| (1)选择A、B、D、G装置组合进行实验 (2)鼓入过量的N2后,分别称量B、D、G的质量 (3)关闭K,点燃A、D处的酒精灯,至草酸完全分解 (4)熄灭A处酒精灯,通入过量的N2,熄灭D处酒精灯,再次分别称量B、D、G的质量 |
B装置增重1.8 g D装置中固体 质量减少0.8 g G装置增重4.4 g |
①A、B、D、G装置的正确连接顺序是A→ → →D ②向A中两次通入N2,其中 第二次的目的是 ③草酸的化学式是 ④反思:若用F代替B,则不能测定草酸的组成,其原因是 |
某化学探究小组的同学为测定某样品中铁的质量分数,他们将样品放入烧杯中,再加入足量的稀盐酸,至不再有气泡产生为止.各步称量数据如下:(稀盐酸的挥发可忽略不计)
生铁样品质量为11.5 g ; 烧杯的质量 为32.5 g ; 所加稀盐酸的质量为200.0 g;
反应后烧杯及所盛物质的总质量为243.6 g 请回答下列问题:
(1)反应中产生气体的质量是 g.
(2)计算该生铁样品中铁的质量分数(写出计算步骤,计算结果精确到0.1%).
小王同学在厨房中发现一袋白色粉末状的食用物,包装袋上表示的化学成分字迹不清,于是他带到实验室探究其成分。(填空每空1分,计算3分,计9分)
【猜想与假设】
猜想1.可能是淀粉(不溶) 猜想2.可能是纯碱
猜想3.可能是食盐 猜想4.可能是 (俗称小苏打)
【查阅资料】小苏打溶液显碱性,与氯化钡溶液不反应,淀粉不溶解于水中
【实验探究】
| 实验操作 |
实验现象 |
实验结论 |
| (1)取样,溶于适量的水 |
形成无色溶液 |
猜想 不成立 |
| (2)取少量品尝 |
有涩味 |
不是 |
| (3)向(1)的溶液中滴加酚酞试液 |
溶液变红 |
是纯碱 |
小华认为,实验(3)结论不准确,原因是 。小华进一步进行了如下实验,取28g所配溶液与50.2g氯化钡溶液混合,两物质签好完全反应。立即出现 ,由此他知道了该白色粉末是何物。过滤,所得滤液的质量为58.5g,试计算
(4)反应后生成的沉淀质量为 克。
(5)所得滤液中溶质的质量分数为多少?
试题篮
()