A、B、C、D、E、F是初中化学内容所涉及到的物质,其中A、B是氧化物,在一定条件下,它们的转化关系如下图所示: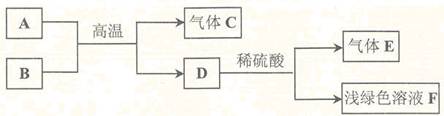
根据上图推断:
(1)C的化学式为________________。
(2)D物质在氧气中燃烧,也能生成B,则B的化学式为______________。
(3)写出D与稀硫酸反应的化学方程式________________________________。
实验室用浓盐酸和MnO2制取并探究Cl2(氯气)化学性质,装置如下:
(1)A是Cl2发生装置,请完成反应的方程式:MnO2 +4HCl(浓) ( )+ Cl2↑+2H2O;除圆底烧瓶外还用到的玻璃仪器有 。
( )+ Cl2↑+2H2O;除圆底烧瓶外还用到的玻璃仪器有 。
(2)从C装置出来的气体中含有CO2和HCl,写出C中反应的化学方程式____________。
(3)在实验中发现:若用稀盐酸代替浓盐酸与MnO2混合加热没有氯气生成。“影响氯气生成的原因是什么呢?”小明作了如下探究:
①提出合理假设
假设1:Cl–的浓度对反应的影响;假设2:
②设计实验方案,进行实验。请在答题卡上写出实验步骤和预期现象及结论。限选实验试剂:浓H2SO4、NaCl固体、MnO2固体、稀盐酸
| 实验序号 |
实验操作 |
预期现象和结论 |
| ① |
|
|
| ② |
|
|
某课外活动小组在学习了铜与氧气反应(2Cu+O2=2CuO)这一性质后,想做一做“空气中氧气含量的测定”实验,并在最后将铜丝进行回收。
(1)课外活动小组对空气中氧气含量的测定做了如下实验:在由两个注射器组成的密闭系统内有50 mL空气,如图。然后给装有铜丝的玻璃管加热。同时交替推动两个注射器的活塞,至玻璃管内的铜丝变黑且较长时间内无进一步变化时停止。停止加热后,待冷却至室温将气体全部推至一个注射器内。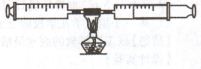
请根据你对上述实验的理解,回答下列问题:
①实验结束后,注射器内空气的体积减少了约 mL,这是因为
②在实验的加热过程中,交替缓慢推动两个注射器的目的是 。
③上述实验只是粗略测定空气中氧气含量的一种方法,你认为造成该实验不够精确的
可能原因是 。
(2)课外活动小组发现红热的铜丝变黑后,为了回收再利用铜丝,在研究如何除去黑色
物质的讨论中,制定了下列方案。
请根据以上方案回答:
① 乙方案的烧杯中发生反应的化学方程式为
两种方案相比较,甲方案的不足之处是 。
②若采用甲、乙两种方案处理此变成黑色的铜丝,并且充分反应,则回收的铜丝a的质
量 (填“<”、“>”、“=”)铜丝b的质量。
下列A~D为初中化学常见物质,其中A为含有金属钠离子的盐,C为大理石的主要成分。它们之间存在下列关系: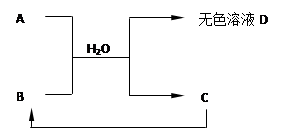
(1)A的化学式 ;C的化学式 。
(2)D中一定含有的溶质是 。用化学方程式表示你判断的理由:
① ;
② 。
(3)D还可能含有的溶质是 。
以食盐为原料进行生产并综合利用的某些过程如下图所示。
(1)除去粗盐中的Ca2+、Mg2+和SO 离子,加入下列沉淀剂的顺序是(填序号) 。
离子,加入下列沉淀剂的顺序是(填序号) 。
a.Na2CO3 b.NaOH c.BaCl2
(2)将滤液的pH调至酸性除去的离子是 。
(3)若向分离出NaHCO3晶体后的母液中加入过量生石灰,则可获得一种可以循环使用的物质,其化学式是 。
(4)纯碱在生产生活中有广泛的应用。
① 纯碱可用于除灶台油污。其原因是 。
②工业上,可以用纯碱代替烧碱生产某些化工产品。如用饱和纯碱溶液与Cl2反应制取有效成分为NaClO(次氯酸钠)的消毒液,其反应的化学方程式是 。(已知碳酸的酸性强于次氯酸HClO)。
有一置于水中用特殊材料制成的密闭容器,气体分子可以通过该容器的器壁,而液体和固体则不能通过。容器质量为1g,体积为0.04L。容器内盛有32.5g质量分数为40%的稀硫酸,如果向其中加入锌粒,要想保持容器在水底不沉底,则锌粒的质量最大不能超过多少?
在托盘天平的两端各放一个盛有相同质量、相同浓度盐酸的烧杯,并使天平保持平衡,在左、右两个烧杯中分别放入等质量了两种金属(保持盐酸过剩),反应完全后发现左杯升高、右杯下降,则左右两个烧杯中分别放入的金属可能是( )
| A.镁和铝 |
| B.锌和镁 |
| C.锌和铜 |
| D.铜和铁 |
将
石灰石样品投入到
稀盐酸溶液中制取二氧化碳气体,恰好完全反应。反应后将溶液过滤、干燥,称量剩余固体残渣的质量为
(提示:①石灰石样品中的杂质不溶于水,也不发生反应;②反应后生成的氯化钙完全溶解)。计算:
(1)该石灰石样品中碳酸钙的质量是多少?
(2)反应后所得溶液的溶质质量分数为多少?(计算结果保留一位小数)
氢氧化钠是重要的化工原料,在保存的过程中如果密封不严容易变质。今年以来,化工原料市场供不应求,各种化工原料价格持续上扬。某化工厂为了增加效益,计划将一批库存的氢氧化钠投入市场。如果你是质检员,请你按以下方案抽取样品对该批氢氧化钠进行检验,看是否变质。
【实验方案】

【推断和结论】
(1)若现象
为有气泡产生,则加入的
溶液可能是,说明氢氧化钠已经变质。
(2)为了进一步探究该产品变质的程度,再取少量样品,加入的
是过量的
溶液(
溶液呈中性),现象
为有白色沉淀,现象
为无色酚酞试液变红色,则证明该批产品(填"部分"或"完全")变质。
【反 思】久置的氢氧化钠变质的原因是(用化学方程式表示).
下列四个图象分别对应四种操作(或治疗)过程,其中图象能正确表示对应操作(或治疗)的是()

A B C D
| A. | 将一定质量的硝酸钾不饱和溶液恒温蒸发水份,直至有少量晶体析出 |
| B. | 常温下,相同质量的锌和铁分别与足量的溶质质量分数相同的稀硫酸充分反应 |
| C. | 向硫酸和硫酸铜的混合溶液中加入氢氧化钠溶液直至过量 |
| D. | 服用胃舒平[主要成分 ]治疗胃酸过多 |
(1)实验室给你提供了下列仪器,请选用合适的仪器完成指定的实验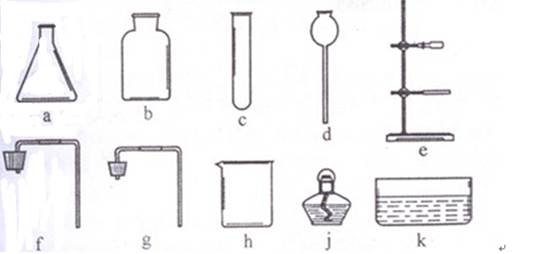
①要制取较多的O2用来探究其性质(要求制取过程中可以添加反应物),组装气体发生装置需要的仪器是 (填序号),收集氧气应采用 法。
②提纯初盐时,过滤需要选用上述仪器中的 (填序号),出此之外还缺少的仪器是滤纸、 、 (填名称)。
(2)美羊羊同学的购物袋装薯片中发现还有一个小袋,上面标有“成分:CaO、Fe;作用:防潮、防氧化;警告:禁止食用”等字样,撕开小袋,发现里面的固体粉末有少许是棕红色,大多数是灰白色的。经过分析,她认为棕红色粉末是Fe2O3,灰白色粉末应该含有CaCO3和Fe,为验证自己的判断,美羊羊同学打算进行实验探究,请你一同参与。
【实验目的】证实灰白色粉末中含有CaCO3和Fe。
【实验设计】装置如下图所示:
【实验预测与分析】
①要证实样品中含有CaCO3,观察到的实验现象是 ,B中发生反应的化学方程式为 。
②若要证实样品中含有Fe,E中应该观察到的现象是 ,此时C装置的作用是
③看了美羊羊同学的分析结论,有同学认为小袋内灰白色粉末中还应该有别的物质,请你写出其中一种物质的化学式 。
七种物质之间具有如下图所示的转化关系。已知:
是一种含铁的矿石的主要成分,其中金属与非金属元素的原子个数比为
;
中铁的质量分数为70﹪,
是有刺激性气味的无色气体,它是形成酸雨的物质之一;
可溶于
的稀溶液并产生气体,该气体是有利于环境保护的理想燃料。请回答下列问题:
①
的化学式为,已知
转化为
时金属元素的化合价升高,则
中非金属元素的化合价是。
②
与
反应的化学方程式是。
③
反应的化学方程式是。
④
与
的稀溶液反应的化学方程式是。
实验室有一瓶未知浓度的BaCl2溶液,某同学取出150g该溶液于烧杯中,向其中逐滴加 入溶质质量分数为26.5%的Na2CO3溶液。反应过程中生成沉淀的质量与所用Na2CO3溶液质量的关系如图甲所示。已知:BaCl2+Na2CO3=BaCO3↓+2NaCl 请计算:
入溶质质量分数为26.5%的Na2CO3溶液。反应过程中生成沉淀的质量与所用Na2CO3溶液质量的关系如图甲所示。已知:BaCl2+Na2CO3=BaCO3↓+2NaCl 请计算:
(1)配制26.5%的Na2CO3溶液80g,需要Na2CO3固体 g。
(2)BaCl2溶液的溶质质量分数是多少?(写出计算过程,结果保留到0.1%)
减弱“温室效应”有效措施之一是大量植树造林,绿色植物在叶绿素存在下的光合作用是完成二氧化碳循环的重要环节。已知叶绿素的相对分子质量小于900,其分子中(以下均指质量分数)含碳 73.8%、氢8.3%、氮6.3%、镁2.7%,其余为氧。试确定叶绿素的化学式。
在一次学生实验中,学生用带有氧化膜的铝片和稀硫酸反应,发现铝片和稀盐酸、稀硫酸反应发现铝片和稀盐酸反应现象明显,而和稀硫酸几乎不反应。这和“铝能跟稀盐酸或稀硫酸反应生成氢气”不一致,是什么原因呢?是试剂、药品出了问题吗?为了寻找原因,某学生在教师的指导重新用浓盐酸配制了一定浓度的溶液,然后加入一块纯度≥99.5%的铝片验证是否确实存在上述现象,实验结果如下表
无论是用5%H2SO4还是用10%H2SO4,均无明显现象。其结论还是与“铝能跟稀硫酸或稀盐酸反应生成氢气”不相符合。
问题1:为了探索“铝与稀盐酸和稀硫酸反应的差异原因”,你能对问题的答案作出哪些假设或猜想:
假设一:Cl-能
假设二:SO42-能
问题二:为了论证上述假设,你设计的实验方案是:(探究过程)_______________
试题篮
()