构建知识网络可以帮助我们理解知识间的内在联系.右图是盐酸与不同类别物质之间反应的知识网络图.请回答下列有关问题:

(1)图中
代表的是类物质.
(2)实验室常用
与稀
反应来制取
写出
的化学式.
(3)盐酸能与碱反应的实质是盐酸中的(离子符号)与碱中的 应生成
(4)工业上常用稀 除去铁锈(主要成分是 )的化学方程式.
一定量的溶液中含有 和 两种溶质,向其中加人lO0 溶质质量分数为37℅的稀 .恰好完全反应且溶液呈中性,将反应后的溶液蒸干.所得固体的质量是
| A. | 7.45 | B. | 14.9 | C. | 5. 6 | D. | 13 8 |
有一无色溶液,已知其溶质是由H2SO4、BaCl2、CuSO4、Na2CO3、KCl、HCl、MgCl2等七种化合物中的两种组成。对该溶液进行相关实验,得出以下实验现象和结论:
①用pH试纸测试,溶液的pH为1;
②加入过量的氢氧化钠溶液,没有沉淀生成。
请根据上述实验现象或结论确定该溶液有可能的组成是:(以下空格可以填满)
、 、 、 、 。
小雨从超市买同一包纯碱,其包装说明如图1所示。他称取了11g纯碱样品溶于
水中配制成50g溶液,然后向溶液中滴加氯化钙溶液,其产生沉淀的质量与滴加氯化钙溶液
的质量关系如图2所示。

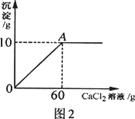
(1)通过计算判断纯碱样品中碳酸钠的质量分数是否与包装说明相符。
(2)计算A点时,所用溶液中溶质的质量分数。(计算结果保留一位小数)
某食品的包装袋中放有一小包“防腐剂”,化学兴趣小组的同学对“防腐剂”的
成分产了好奇,他们将一包“防腐剂”倒在滤纸上,看到“防腐剂”中有一些灰黑色粉末
和一些红色粉末,为此,展开以下探究活动:
【提出问题】“防腐剂”中灰黑色的粉末和红色的粉末分别是什么?
【查阅资料】食品腐败主要是因为食品易被空气中的氧气和水蒸气氧化、潮解而变质,使用
“防腐剂”可延长食品的保质期。
【提出猜想】
小文:“防腐剂”中灰黑色的粉末是氧化铜,红色的粉末是铜。
小婧:“防腐剂”中灰黑色的粉末是氧化铜和碳粉,红色的粉末是铜。
小鹏:“防腐剂”中灰黑色的粉末是铁粉和碳粉,红色的粉末是氧化铁。
【讨论分析】通过讨论,同学们一致认为小鹏的猜想是正确的,理由是 。
【实验探究】请你参与他们的探究,并将实验内容补充完整。
【拓展探究】为了进一步探究“防腐剂”的性质,兴趣小组的同学另取一包“防腐剂”,进行了如右图所示的实验。实验结束后,通过称量反应前后玻璃管中固体物质的质量,他们发现反应固体物质的质量减小了,请你分析固体物质质量减小的原因 。
碳酸氢钠常用于食品和医药工业、某化学兴趣小组对碳酸氢钠的热稳定性进行探究。
[查阅资料]碳酸氢钠受热易完全分解,生成水、二氧化碳气体和一种常见固体物质,该固体物质含有三种元素,且为纯净物。
[进行实验一]为了验证碳酸氢钠受热时会分解,该兴趣小组的同学取一定质量的碳酸氢钠放到铜片上加热,如图所示。

加热一段时间后,观察小烧杯内壁有现象,证明有水生成;通过证明有
生成。
[提出问题]碳酸氢钠充分加热后固体产物是什么?
[作出猜想]猜想Ⅰ:固体产物是
.
猜想Ⅱ:(请完成猜想Ⅱ)。
[进行实验二]下表是该兴趣小组同学设计的实验方案,用来检验碳酸氢钠分解后固体产物的成分。请你完成方案:

[拓展应用]碳酸氢钠常用来治疗胃酸过多,但对于患有胃溃疡(胃黏膜溃烂)的病人在胃酸(可用盐酸表示)过多时,却不宜服用碳酸氢钠,其原因是(用化学方程式表示)。
图14中字母A~I分别表示不同的常见物质。"→"表示物质间存在转化关
系,部分反应条件和部分生成物已略去。

请回答下列问题:
(1)反应①的基本反应类型为。
(2)写出与A具有相同元素组成的另一种物质的名称和其一种用途:名称用途
。
(3)写出C、G的化学式:G。
(4)写出反应②的化学方程式:。
某研究性学习小组对"
的水溶液是否显酸性"进行探究。请你参与他们的探究活动,并回答有关问题。
(1)查阅资料:①
是一种无色、有臭鸡蛋气味的有毒气体,能溶于水,在常温常压下,1体积水中能溶解2.6体积硫化氢;密度比空气的大;②实验室里,通常用硫化亚铁(
)固体跟稀盐酸或稀硫酸反应制取硫化氢。
(2)提出假设:
的水溶液显酸性
(3)实验探究:
Ⅰ.制备
①若用稀盐酸制备
,其化学方程式为。
②制取H2S的发生装置为(填字母),收集装置只能选D的原因是。
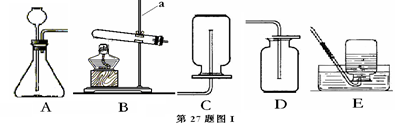
Ⅱ.设计如第27题图II所示装置进行验证实验。

①实验过程中,A装置内蓝色石蕊试纸的颜色始终没有变化。A装置的作用是。
②在通入
之前将B装置中胶头滴管内的蒸馏水滴到蓝色石蕊试纸上,未见试纸颜色发生变化,此操作的目的是。当有
通过时发现湿润的蓝色石蕊试纸变红,此现象说明。
(4)结论:原假设成立。
(5)反思与评价:该验证实验中,有一个明显疏漏,请你指出疏漏之处为。
(6)知识拓展:
的水溶液显酸性,具有酸的通性,若用氢氧化钠溶液吸收尾气,则反应的化学方程式为。
氯化镁是制取镁的原料之一。现要测定某化工产品(含MgCl2和KCl)中所含的氯化镁质量分数,进行实验:先将10g样品完全溶于水,然后把50g一定质量分数的氢氧化钾溶液平均分五次加入样品溶液中,充分振荡,实验所得数据见下表:

请分析上述数据,回答下列问题:
(1)表中a为。
(2)样品中的氯化钾属于化肥中的肥,可回收利用。
(3)所用的氢氧化钾溶液中溶质的质量分数是。
(4)计算样品中氯化镁的质量分数是多少?(写出计算过程)
兴趣小组选用第15题中的B装置(装置气密性良好)制
,并进行有关实验。
(1)实验室制取
的化学方程式为。
(2)兴趣小组往石灰石中逐滴滴入新配制的盐酸,并将所得气体通入澄清石灰水中,但石灰水始终没有浑浊现象。石灰水为什么没有浑浊呢?请你利用必需实验用品和限选试剂(限选试剂:
溶液、酸化的
溶液、紫色石蕊溶液)完成探究过程:
【提出猜想】①;②;③上述两种猜想同时存在。
【设计与实验】请你设计实验方案,验证猜想①和猜想②,并将相关内容填在下表:
碱式氯化铝是某种高效净水剂的主要成分。实验室利用铝土矿(主要含
,还含少量
及其他不溶杂质)制取碱式氯化铝的过程如下:

(1)溶解过程中,需要使用质量分数为15%的盐酸,则配制这种盐酸需要mL,30%的浓盐酸(密度约为1.15g/cm3)和115g蒸馏水。
(2)盐酸溶解铝土矿过程中,发生反应的化学方程式为。
(3)加少量铝粉的主要作用是:除去浊液中的。
(4)加
粉末的作用是调节pH至5。请写出用pH试纸测定溶液pH的操作:在白瓷板或玻璃片上放一小片pH试纸,,得出被测液的pH。
某学习小组对市售"管道通"(排水管专用清洁剂)说明书的部分内容(如下图所示)产生兴趣,探究过程如下:
成 分:苛性钠、碳酸钠、铝粒、催化剂.
特 点:使用时,"管道通"样品倒入排水口,加水,瞬间释放高效泡沫,能溶解油脂、毛发、茶叶等,确保管道畅通.
注意事项:使用时不能碰明火,禁止与皮肤接触.
【提出问题】高效泡沫中含有什么气体
为什么使用时不能碰明火
【猜 想】含有氢气.
(1)查阅资料得知:常温下,铝能与氢氧化钠溶液反应放出氢气.反应的化学方程式是
,试推测
的化学式是.
(2)取"管道通"样品进行下图所示实验.请在下表空格处填写相应内容:
| 实验内容 | 实验现象 | 实验结论及解释 |
制取气体 |
样品逐渐减少,产生大量气泡,盛装样品的试管外壁发烫 | ①反应生成气体,并(填"吸收"或"放出")热量 |
| 检验气体
|
发出爆鸣声 | ②该气体是,反应的化学方程式为 |
(3)"注意事项"中,"禁止与皮肤接触"是因为"管道通"成分中的有强腐蚀性,使用时"不能碰明火"的理由是.
右图是酸与不同类别物质之间反应的知识网络图。

(1)图中
若代表金属氧化物,请举一个例子;
代表(填物质的类别)。
(2)写出金属与稀
反应的化学方程式:,所属基本反应类型是。
(3)酸有一些相似的化学性质,是因为在不同的酸溶液中都含有相同的(填离子符号)。
试题篮
()