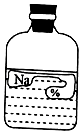
实验室中有一瓶标签破损的固态铵盐,它可能是NH 4Cl、NH 4NO 3、NH 4HCO 3、(NH 4) 2SO 4中的一种,请利用如图所示的溶液进行实验探究。
【提出猜想】猜想①:该铵盐是NH 4Cl
猜想②:该铵盐是
猜想③:该铵盐是NH 4HCO 3
猜想④:该铵盐是(NH 4) 2SO 4
【实验探究】步骤一:取少量样品放入试管中,没有嗅到强烈的氨味,加入适量水溶解得到无色液体,选用图中的 溶液滴入试管中,无气泡放出,则猜想③不成立。
步骤二:在步骤一所得的溶液中,滴加图中的Ba(NO 3) 2溶液,没有白色沉淀生成,则猜想 不成立。
步骤三:另取适量样品放入试管中,加水溶解配成溶液,滴加图中的 溶液,有白色沉淀生成,则猜想 成立。
【拓展应用】铵盐可作氮肥,它会与碱性物质发生化学反应,请写出硝酸铵溶液与氢氧化钠溶液在加热条件下反应的化学方程式 ,所以在农业生产中,为避免降低肥效,铵态氮肥不要与碱性物质混合施用。

实验室有一瓶常用无色液体的标签模糊了(如图)。为确定该瓶溶液的溶质是什么,同学们进行了如下探究:
[提出问题]这瓶溶液的溶质是什么?
[作出猜想]猜想1:NaOH 猜想2:Na 2CO 3猜想3:NaHCO 3猜想4:NaCl
[查阅资料]NaHCO 3溶液显碱性,NaHCO 3溶液不与CaCl 2溶液反应。
[实验探究]
| 实验步骤 |
实验现象 |
实验结论 |
| 小亮取2mL该无色溶液于试管中,滴加2滴无色酚酞溶液 |
溶液变红 |
猜想1、3成立、猜想2、4不成立 |
| 小丽取2mL该无色溶液于试管中,加入3mL稀盐酸 |
立即产生气泡 |
猜想 不成立 |
[交流讨论]
(1)同学们一致认为小亮的实验结论不正确,理由是 。
(2)为了确定该无色溶液到底是什么,小强继续进行如下实验:
①取2mL该无色溶液于试管中,滴加CaCl 2溶液,边加边振荡,观察到产生白色沉淀。由此得出猜想 成立,反应的化学方程式为 。
②另取2mL该无色溶液于试管中,逐滴加入稀盐酸,一段时间后才观察到有气泡产生。
[拓展思考]小丽和小强都向无色溶液中加入稀盐酸,为什么现象不同?
[延伸探究]同学们查阅资料发现:向Na 2CO 3溶液中逐滴加入稀盐酸时,反应分两步进行:Na 2CO 3+HCl═NaHCO 3+NaCl;NaHCO 3+HCl═NaCl+CO 2↑+H 2O.故出现小强的实验现象。
[应用提升]现有两瓶失去标签的无色溶液,已知它们分别是碳酸钠溶液和稀盐酸中的一种,若不另加任何试剂要将二者鉴别开,你的鉴别方案是 (写出操作方法、现象和结论)。
实验室有一瓶标签被腐蚀的无色溶液,是稀硫酸和氢氧化钠溶液中的一种。在老师的指导下,小红和小明用不同方法鉴定。
实验一:
实验步骤 |
实验现象 |
实验结论 |
小红取少量该溶液于试管中,向其中插入没有打磨的铝片 |
开始无明显现象,后产生 |
小红认为该溶液为稀硫酸 |
小明用pH试纸测定其pH |
pH=13 |
小明认为该溶液为氢氧化钠溶液 |
小红和小明操作均无误。
【提出问题】
该溶液到底是稀硫酸还是氢氧化钠溶液?
【查阅资料】
铝、氧化铝既能与酸反应,又可与强碱溶液反应,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,氧化铝与氢氧化钠溶液反应生成偏铝酸钠( NaAlO2)和一种氧化物。NaAlO2易溶于水,其水溶液呈碱性,NaAlO2与铝、氧化铝均不反应。
【分析实验得出结论】该溶液为 溶液。
【交流反思】实验一中,小红所做实验开始无明显现象的原因是 。(用化学方程式表示)
【拓展应用】有一种管道疏通剂,主要成分为铝粉和氢氧化钠粉末。工作原理是:利用铝和氢氧化钠遇水反应放出大量的热,加快氢氧化钠对油脂和毛发等淤积物的腐蚀,同时产生氢气增加管道内气压,利于疏通。
实验二:小明用如图所示的玻璃弯管模拟家庭下水道,并用动物脂肪和毛发堵在弯管处,他按照使用说明从左端管口加入管道疏通剂,并用胶塞堵住弯管左端上口,可能出现的现象为 (填字母序号)。
A.产生大量气体
B.弯管内温度升高
C.堵塞物变软被气体赶出,落入烧杯中
实验三:为了证明烧杯中废液里是否还含有氢氧化钠,小明做了如下实验
实验操作 |
实验现象 |
实验结论 |
取少量澄清废液于试管中,滴入酚酞 |
溶液变红 |
废液中有氢氧化钠剩余 |
小红对小明的结论提出了质疑,理由是 ,小红把酚酞改用 (填药品)进行实验,得出废液中还含有氢氧化钠。
管道疏通剂中氢氧化钠过量,可确保铝粉反应完全,并且过量的氢氧化钠对下水道有清污的作用。

化学实验室有失去标签的稀硫酸、氢氧化钠、氢氧化钙、碳酸钠、氯化钡五瓶无色溶液,将其任意编号为:A、B、C、D、E,然后两两混合进行实验,其部分实验现象如下表(说明:硫酸钙视为可溶物)
实验 |
A+B |
B+C |
B+D |
C+D |
现象 |
产生沉淀 |
产生气体 |
产生沉淀 |
产生沉淀 |
(1)写出溶液A中溶质的化学式:A 。
(2)写出溶液A与B反应的化学方程式 。
(3)写出溶液C和D反应的化学方程式 。
酸、碱、盐在生产生活中具有广泛的用途。
(1)化学实验室有失去标签的稀硫酸、氢氧化钠、氢氧化钙、碳酸钠、氯化钡五瓶无色溶液,现将其任意编号:A、B、C、D、E,然后两两组合进行实验,其部分现象如表(微溶物视为可溶物):
实验 |
A+B |
A+C |
A+D |
B+C |
现象 |
产生气体 |
产生沉淀 |
产生沉淀 |
产生沉淀 |
①写出溶液B、C中溶质的化学式:B ,C 。
②写出溶液A与D反应的化学方程式 。
(2)我国制碱工业先驱侯德榜发明了“侯氏制碱法”,其主要化学原理:
NaCl+H2O+NH3+CO2=NaHCO3↓+X;
2NaHCO3 Na2CO3+H2O+CO2↑等。
Na2CO3+H2O+CO2↑等。
回答下列问题:
①X的化学式为 。
②将碳酸钠和碳酸氢钠的混合物l0g充分加热至质量不再改变,冷却,称量剩余固体质量为6.9g,则原混合物中碳酸钠和碳酸氢钠的质量比为 (写最简比)。
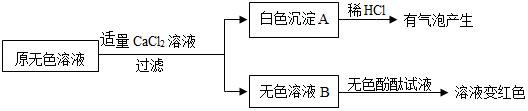
在整理实验室时,同学发现7瓶不同的无色溶液(见如图所示),其中2、3、7号试剂瓶标签完全破损,4、5号试剂瓶标签部分破损。查阅药品记录单可知,2、3、4、5、7号溶液分别是10% NaOH溶液、饱和石灰水、10% Na2CO3溶液、10% CaCl2溶液、10%稀盐酸中的一种。化学小组同学进行了以下实验探究。
[实验目的]①给试剂瓶贴上正确的标签;②探究部分溶液混合发生的反应。
[查阅资料]①CaCl2溶液呈中性,能与Na2CO3发生复分解反应;
②Ca(OH)2+NaHCO3═CaCO3↓+NaOH+H2O NaOH+NaHCO3═Na2CO3+H2O
[实验探究]
(1)分别取2、3、4、5、7号溶液于5支试管中,向其中分别滴加1号溶液,发现3、4、5号溶液变红色,说明这3种溶液呈 (填“酸性”、“碱性”或“中性”),由该实验可确定的溶液为 (写出试剂瓶编号及相应的溶液名称);
(2)分别取2号5.55g和7号3.65g溶液,混合均匀后,逐滴加入5号溶液。首先观察到有气泡冒出,然后有沉淀析出。加入5号溶液的质量与产生气体或沉淀的质量关系如图1所示,加入5号溶液的质量与溶液pH的变化关系如图2所示。根据图示完成下列问题:

①7号溶液是 (填名称);
②图1中b点数据为 g;
③图2中h→k段发生反应的化学方程式为 。
(3)取3号溶液于试管中,逐滴加入一定量的6号溶液,观察到溶液变浑浊,过滤,则滤液中含有的溶质可能为①NaOH;②Na2CO3;③NaOH、Na2CO3;④NaOH、Ca(OH)2;⑤ 。
[实验反思]分析上述实验,下列说法不正确的是 (填字母序号)。
A.5号试剂可能是部分变质的氢氧化钠溶液
B.该实验无法确定各种试剂,没有完成实验目的①
C.图1中b→c段反应过程中溶液的pH变化情况可用图2中h→k段表示
D.碳酸氢钠既能与碱反应,又能与酸反应
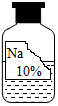
某兴趣小组在实验室里准备常见酸、碱、盐的性质实验时,发现实验台上摆放的药品中,有一瓶未盖瓶塞且标签破损的溶液(如图),他们决定对这瓶溶液的成分进行探究。
【提出问题】这瓶溶液的溶质是什么?
【获得信息】
(1)酸、碱、盐的性质实验中用到含钠元素的物质有氯化钠、氢氧化钠、碳酸钠、碳酸氢钠。
(2)实验室里盛放碱性溶液的试剂瓶通常使用橡胶塞。
(3)碳酸氢钠溶液与氯化钡溶液不反应;氯化钡溶液呈中性。
【提出猜想】猜想一:氢氧化钠; 猜想二:碳酸钠; 猜想三:碳酸氢钠。
【实验探究】
(1)小军取样滴加稀盐酸有 产生,得出结论:该溶液的溶质是碳酸钠或者是 。
(2)小军另取样加入过量的氯化钡溶液,观察到有 产生,进而得出结论:该溶液的溶质是碳酸钠。
(3)小华认为小军的结论不完全正确,理由是 。
小组同学讨论后一致认为还需要进行如下实验:
(4)取小军第二次实验后的上层清液,滴入无色酚酞试液,溶液呈红色。
【实验结论】这瓶溶液的原溶质是 。
【探究启示】实验中取用液体药品时,应注意 。

实验室有一瓶标签残缺并且瓶盖没有完全密封的无色溶液(如图),化学小组的同学经过寻问老师后只知道是NaCl、NaOH、Na2CO3、NaHCO3中的一种溶液,为确认原瓶中是何种溶质并判断其是否变质,化学小组的同学进行了如下的探究活动:
[进行猜想]
猜想I:原溶液的溶质是NaCl;
猜想II:原溶液的溶质是NaOH;
猜想III:原溶液的溶质是Na2CO3;
猜想IV:原溶液的溶质是NaHCO3。
[查阅资料]
常温下,有关物质的相关信息如下表:
物质 |
NaCl |
NaOH |
Na2CO3 |
NaHCO3 |
常温下的溶解度/g |
36 |
109 |
21.5 |
9.6 |
常温下稀溶液的pH |
7 |
13 |
11 |
9 |
从物质的相关信息可知,原溶液的溶质一定不是NaHCO3,因为 。
[进行实验]
(1)取少量样品,测得溶液的pH大于7,则原溶液的溶质肯定不是 。
(2)同学们另取样品又进行了如下实验,实验过程如下:
①生成白色沉淀A的化学方程式 。
②通过实验可以判断样品无色溶液中含有的溶质有
[获得结论]
实验完成后,最终得到的结论:原瓶中的溶质是 ,且已变质。
实验室有一瓶标签腐蚀的溶液A(如图),某组同学将碳酸钠溶液与样品反应,有白色沉淀产生,过滤后得到澄清滤液,同学们进行了一系列的探究。
探究一 A溶液中溶质是什么?
【提出猜想】①CaCl 2,② 。
【查阅资料】CaCl 2溶液呈中性。
【设计实验】同学们设计了如下方案并进行实验。
| 实验操作 |
实验现象 |
实验结论 |
| 取少量A溶液于试管中,向其中滴加无色酚酞溶液 |
|
猜想①正确 |
碳酸钠与其反应的化学方程式为 。
探究二 过滤后的滤液中会有哪些溶质?
【提出猜想】小明的猜想:NaCl、CaCl 2;小红的猜想:NaCl;你的猜想:
【设计实验】请设计对"你的猜想"实验:
| 实验步骤 |
实验现象 |
实验结论 |
|
|
|
你的猜想正确 |
[思维拓展]为防止标签被腐蚀,倾倒液体时应注意: 。

实验室有一瓶标签受到腐蚀的无色溶液,如图所示.这瓶无色溶液是放在存放盐溶液的柜子里.化学兴趣小组开展探究:
【提出问题】这瓶无色溶液究竟是什么盐的溶液?
【猜想与假设】该无色溶液可能是碳酸钠、碳酸氢钠、氯化钠、硫酸钠、硝酸钠中某一种的溶液.
【初步分析】
(1)库尔班同学根据标签上的组成元素认为一定不是 溶液.
(2)艾力同学提出,碳酸氢钠、硝酸钠的溶液也不可能,他的依据是 .
【设计实验】为了确定该溶液究竟是剩余两种盐的哪一种溶液,他们设计了如下实验.
| 实验操作 |
实验现象 |
| ①取少重该无色溶液于试管中,慢慢滴加BaCl 2溶液 ②静置后,向沉淀中滴加稀盐酸 |
产生白色沉淀 产生大量气泡,沉淀全部溶解. |
【实验结论】
(3)该瓶无色溶液的溶质是 (填化学式).生成白色沉淀的化学反应方程式是 .
【实验反思】
(4)玉素甫同学认为原设计的实验还可简化,同样达到鉴别的目的.丙同学设计的实验如下(将实验操作及实验现象填入相应的空格中):
| 实验操作 |
实验现象 |
| |
|
(5)白燕同学经查阅资料得知:氯化钠、硫酸钠、硝酸钠溶液呈中性,碳酸钠、碳酸氢钠溶液呈碱性,提出测溶液的酸碱性来确定更简便.她采用 测量溶液的pH值 7(填>、=、<),则结论与以上同学一致.

有一瓶标签受损、没盖瓶盖且装有无色液体的试剂瓶,如图所示。
老师告诉大家,瓶内原有的液体只能是碳酸钠溶液、氢氧化钠溶液、氯化钠溶液、蒸馏水中的一种。为了判断瓶内是何种溶质,并确定试剂瓶的标签,化学小组的同学进行了如下探究活动。
[实验探究]
(1)从受损的标签信息看,大家一致认为该液体不可能是 。
(2)甲同学设计了如下方案进行探究。
| 实验操作 |
实验现象 |
实验结论 |
| 取适量瓶内液体加入试管中,滴加足量的稀盐酸 |
|
该液体是碳酸钠溶液 |
(3)乙同学认为甲同学的结论不准确,又设计了如下方案进行探究。
| 实验操作 |
实验现象 |
实验结论 |
| 取适量瓶内液体加入试管中,滴加过量Ca(OH) 2溶液。静置后,取上层清液,滴加酚酞溶液 |
|
该液体中的溶质为氢氧化钠和碳酸钠。反应的化学方程式: |
(4)丙同学认为乙同学的实验方案有不足之处,于是丙同学只改用了一种与乙同学所加物质类别不同的溶液,重新按照乙的方法进行实验,得到的实验现象和结论与乙同学的完全一致,且结论完全正确。则丙同学改用的试剂为 。
[实验结论]实验结束后,最终得到的结论是:原试剂瓶标签 。
[反思与交流]
(1)为了不使标签破损,应如何正确操作 。
(2)药品取完之后应及时密封保存。

现有2瓶无色且失去标签的碳酸钠溶液和氢氧化钠溶液,如何鉴别,其方案很多.
[提出问题]仅提供氢氧化钙溶液和稀盐酸,能否将碳酸钠溶液和氢氧化钠溶液区别开来?
[猜想假设]将失去标签的两种溶液分别编号为A、B,假设A为碳酸钠溶液,B为氢氧化钠溶液.
[设计思路]现有甲、乙两位同学分别思考得出如下初步鉴别思路:
甲:将两种溶液取样,分别滴入稀盐酸,根据是否有气泡产生来判断各是哪种溶液.
乙:将两种溶液取样,分别滴入氢氧化钙溶液,振荡,根据是否有白色沉淀生成来判断各是哪种溶液.
(1)以上两种思路是否都正确 (填“都正确”或“一个正确一个不正确”)
[实验探究]请参与下列实验过程:
(2)请在上述实验思路中选择一个你认为正确的思路 (填“甲”或“乙”)
进行实验
(3)填写出实验报告:
实验步骤 |
实验现象 |
结论、化学反应方程式 |
①将A、B两溶液各取少 量,分别放入两支试管中; ② |
A溶液样品中有:
|
则A 为 溶液 B 为 溶液 反应的化学方程式为:
|
[发散思维]鉴别碳酸钠溶液和氢氧化钠溶液,还可从下列试剂中选取.请你选择一种能鉴别这两种溶液的试剂 (请填写序号)
A.KOH B.Na2SO4 C.BaCl2 D.NaCl.
有三瓶失去标签的无色溶液,它们可能是稀HCl、稀H2SO4、Na2CO3、NaNO3、NaCl、Ba(OH)2这六种溶液中的三种.为确定它们各为何种溶液,小明做了如下实验:
(1)把它们两两混合,均无明显现象.
(2)取样,往样品中分别滴加紫色石蕊溶液.有一种溶液变红色,另一种溶液不变色,剩下的一种溶液变蓝色.能使紫色石蕊溶液变蓝色的原溶液显 (填“酸性、中性、碱性”).
(3)综合(1)(2)步实验现象及结论,可推断出这三种溶液中的一种溶液一定是Ba(OH)2溶液,还有一种溶液一定是 ;为确定剩下的另一种溶液,再取样,往其中滴加一种无色溶液,产生白色沉淀,请写出其化学方程式: .
化学兴趣小组的同学发现实验台上有一瓶标签残缺的试剂(如图),同学们对此进行了如下探究。
【提出问题】这是一瓶什么溶液?
【猜想与假设】海天同学的猜想是Na2SO3溶液;刘浩同学的猜想是Na2SO4溶液;你的猜想是 (写一种)。
【查阅资料】
Ⅰ白色沉淀BaSO3不溶于水,但要溶于稀盐酸。
Ⅱ硝酸具有强氧化性,能将BaSO3氧化成BaSO4。
ⅢNa2SO3与稀盐酸反应产生SO2,SO2能使石灰水变浑浊,也能使品红溶液褪色。
【进行实验】
Ⅰ海天同学取适量的该溶液于试管中,滴加稀盐酸,产生无色气体,他认为自己的猜想成立,而刘浩同学认为他的结论不合理,原因是 。
Ⅱ刘浩同学为了验证自己的猜想,做了如下实验:
取适量的该溶液于试管中,先滴加足量的BaCl2溶液,再滴加过量稀硝酸,现象为 ,刘浩同学认为自己的猜想成立。
Ⅲ卓玛同学对刘浩同学的猜想又提出了质疑,她认为加BaCl2和稀硝酸,Na2SO3也会产生沉淀,为了验证自己的观点,做了如下实验:
步骤 |
操作 |
实验现象 |
实验结论 |
步骤1 |
取少量该溶液于试管中,滴加足量的BaCl2溶液 |
|
无 |
步骤2 |
向步骤1的试管中滴加足量的稀盐酸 |
|
此溶液不是Na2SO4 |
步骤3 |
将步骤2中产生的气体通入品红溶液 |
品红溶液褪色 |
|
写出卓玛同学实验过程中的化学方程式: , 。

某校兴趣小组的同学准备进行常见酸、碱、盐的性质实验时,发现实验台上摆放的药品中有一瓶溶液的试剂瓶未盖瓶盖且标签破损(如图),于是决定对该瓶溶液进行实验探究:
【提出问题】这瓶溶液是什么溶液?
【获得信息】酸、碱、盐的性质实验中用到含有钠元素的物质是氯化钠、氢氧化钠、碳酸钠.
【做出猜想】:猜想一:这瓶溶液是氯化钠溶液;
猜想二:这瓶溶液是氢氧化钠溶液;
猜想三:这瓶溶液是碳酸钠溶液.
【实验推断】
(1)小明取样滴加无色酚酞溶液,溶液呈红色,得出结论:该溶液不可能是 溶液,原因是 .
(2)小李另取样滴加稀盐酸,观察到有气泡产生,由此得出结论:该溶液是碳酸钠溶液,反应的化学方程式是 .
(3)小王认为小李的结论不完全正确,理由是 .
大家讨论后一致认为还要进行如下实验:
【继续探究】另取样加入过量的CaCl2溶液,观察到有 产生,设计这一步骤的目的是 ,静置后,取上层清液,滴入酚酞溶液,溶液呈红色.
【实验结论】这瓶溶液是 .
【探究启示】实验取完药品后应立即盖好瓶塞,且取用药品时标签向着手心.
【拓展迁移】若该溶液与盐酸发生中和反应,恰好完全反应的微观过程如图2所示,反应实质是 .
试题篮
()