在高温下,铁与水蒸气能发生反应生成一种常见的铁的氧化物和一种气体.某兴趣小组请你参与研究:铁与水蒸气反应一段时间后剩余固体物质的成分、性质及再利用.

(1)【推断】观察到D中黑色固体变红,则B中生成的气体是 .
(2)探究B装置中剩余固体成分是什么?
【查阅资料】
1.碎瓦片能防爆沸,碱石灰是氧化钙和氢氧化钠的混合物
2.铁的氧化物中,只有Fe 2O 3是红棕色,其余均为黑色,只有Fe 3O 4能被磁铁吸引.
【初步探究】B装置中剩余固体为黑色,能全部被磁铁吸引
【猜想与假设】
猜想一:剩余固体是Fe 3O 4
猜想二:剩余固体是
【实验探究】
| 实验操作 |
实验现象及结论 |
【实验结论】铁与水蒸气反应的化学方程式为
(3)【成分再利用】若将B装置中剩余的黑色固体ag,经过一系列转化,全部变为红棕色固体Fe 2O 3(假设转化过程中铁元素无损耗),增加的质量为x,则x的取值范围为 .
氢氧化镁是一种重要的化工原料,某矿石由MgO、Fe 2O 3、CuO和SiO 2组成,用它制备氢氧化镁的流程示意图如图:
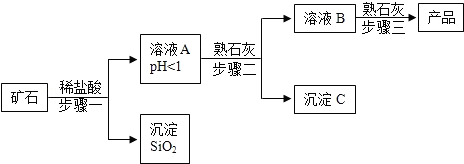
(1)请写出步骤一中发生反应的化学方程式: (任写一个)
(2)溶液A中所含的阳离子有 (填离子符号)
(3)已知:部分金属阳离子以氢氧化物形成沉淀时溶液的pH见表
| 沉淀物 |
Fe(OH) 3 |
Cu(OH) 2 |
Mg(OH) 2 |
| 开始沉淀 |
1.9 |
4.2 |
9.1 |
| 完全沉淀 |
3.2 |
6.7 |
11.1 |
步骤二中加入熟石灰,调节溶液的pH范围为
(4)3个步骤中均用到的操作是
(5)步骤三中生成产品的化学方程式为 。
将一小块银白色的金属钠放置在空气中会发生下列变化:
钠(Na) 钠的氧化物
钠的氧化物  氢氧化钠溶液
氢氧化钠溶液  白色固体
白色固体
[提出问题]:常温下钠与氧气反应,产物有哪些?
[查阅资料]:(1)钠的氧化物,除氧化钠(Na2O)外还有过氧化钠(Na2O2),氧化钠与过氧化钠都能与水发生反应,其反应的方程式如下:
Na2O+H2O=2NaOH;2Na2O2+2H2O=4NaOH+O2↑
(2)CaCl2溶液呈中性
[作出猜想]:常温下钠与氧气反应的产物可能为.
猜想1:① 猜想2:Na2O2,猜想3:Na2O2和NaOH
[实验探究一]:
实验操作 |
实验现象 |
实验结论 |
取少量钠的氧化物加入足量蒸馏水 |
② |
猜想1正确 |
[继续探究]:钠在空气中放置较长时间发生反应生成的白色固体
[作出猜想]生成的白色固体可能是1是:Na2CO3 2是:Na2CO3和NaOH
[实验探究二]:
实验操作 |
实验现象 |
实验结论 |
1.取少量白色固体配成溶液,加入适量CaCl2溶液 |
③ |
白色固体成分为Na2CO3和NaOH |
2.将上述反应后的溶液过滤,取少量滤液滴加④ |
⑤ |
[反思拓展]
1.也可以用稀盐酸区别Na2O与Na2O2,Na2O2与稀盐酸的化学反应方程式为:2Na2O2+4HCl=4NaCl+2H2O+X↑,X的化学式为⑥ .
2.实验结束后,废液缸中溶液显碱性,请你设计一个实验方案处理废液⑦ .
化学活动课上同学们对金属的性质及合金的成份进行了探究,请你参与。
(1)取等质量的金属,分别加入足量稀硫酸,完成如表四组实验。
药品/序号 |
A |
B |
C |
D |
金属 |
铜粉 |
锌粉 |
锌粉 |
镁粉 |
稀硫酸 |
9.8%硫酸 |
19.6%硫酸 |
9.8%硫酸 |
9.8%硫酸 |
①写出实验中一个反应的化学方程式 。
②根据表中 实验(选填序号),即可判断Mg、Cu、Zn三种金属的活动性顺序。
(2)探究合金的成份,某合金可能由Mg、Cu、Zn、Al四种金属中的两种组成。
[提出问题]合金由哪两种金属组成?
[实验探究]①取该合金m1g,在足量氧气中反应,生成固体质量为m2g,m1和m2的关系如图所示,则(m2﹣m1)g表示的意义是 。
②再向m2g的固体中加入稀硫酸,微热,固体全部溶解,得溶液M,继续进行如下实验,补充完成内容。
实验操作 |
实验现象 |
结论和化学方程式 |
向M中加入ag铁粉、搅拌 |
化学方程式: M中的溶质: |
|
过滤,把所得固体洗涤、干燥,称其质量也为ag,并向此固体中加入稀硫酸 |
无明显现象 |
[分析结论]③若m1=4,m2=7.2,结合上述实验分析,合金的成份是 。
(3)根据上述实验总结金属的化学性质 。
探究酸、碱和盐的性质及应用.

(1)NaOH溶液和稀硫酸反应,向滴有酚酞的NaOH溶液中加入稀硫酸,现象为 ,反应的化学方程式为 .
(2)为除去NaCl中混有的少量Na2SO4,某探究小组设计了如图所示方案进行实验.
①Ⅰ、Ⅱ两步都有过滤操作,过滤中要用到的玻璃仪器有 .
②甲、乙同学选用的X分别为BaCl2溶液、Ba(OH)2溶液,写出Ⅰ、Ⅱ两步中发生的任意一个反应的化学方程式 ,甲、乙同学的实验中,可能发生的相同反应的化学方程式为 ,乙的实验中,步骤Ⅲ涉及的操作和现象是 .
③丙同学认为甲的实验比乙的实验更合理,理由是 .
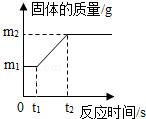
梧州市某中学化学学习小组的同学,在进行电解水试验时发现他们的装置只有一端有气体产生,且溶液颜色逐渐加深.
对此异常现象,小吴同学认为是电源正负极接反了的原因.要证明小吴的猜想,应该进行的操作是 .经过修正,大家完成了电解水的实验.体验到"电解"这种新实验手段的威力后,大家意犹未尽,决定继续深入探究.
【探究活动一】
小吴将水换成食盐水进行电解,A、B两个试管都收集到气体.试管A收集到的是无色可燃性气体,则该气体是 气.
【问题与猜想】
试管B收集到的气体可能是什么呢?请你根据质量守恒定律进行大胆猜测,并将所有可能的属于单质气体的化学式填写在横线上 .
【实验与结论】
若小周用pH试纸测出电解后溶液的pH为12,说明该溶液呈 性,则电解食盐水的化学方程式为 .
【探究活动二】
小周将原装置的电极都改为铜片进行食盐水的电解,结果发现溶液颜色变蓝.
【问题与猜想】
为什么溶液会变蓝色?小施认为可能是铜片变成铜离子进入溶液中的原因.
【实验与结论】
小施取少量蓝色溶液放入试管中,滴入氢氧化钠溶液后,观察到 的现象,证明了自己的猜想正确.你还有其他证明溶液中含Cu 2+的方法吗?请写出你的方法和结论 .
【回顾与反思】
经过上述拓展探究实验,同学们学会了用身边的物质进行探究的方法,体验到了开拓思路大胆探究的乐趣,感受到了化学的神奇魅力,根据上述所进行的实验,请写出你还想探究的一个问题 .
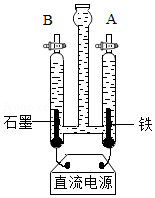
工业上采用氨碱法生产纯碱,主要流程如下图,请据图回答相关问题.

(1)氨碱法生产所得产品为纯碱,向纯碱水溶液中滴入无色酚酞试液显 色.
(2)从步骤①提取粗盐常用 (填“蒸发结晶”或“降温结晶”)方法.
(3)从酸碱反应的角度分析,步骤④中通入氨气的作用是 .
(4)步骤⑤所得的碳酸氢钠在生产和生活中有许多重要用途,请写出它的一种途径 .
(5)步骤⑥中发生反应的化学方程式为 ,该反应类型属于 反应.
氯化钙在生活中常用作干燥剂、融雪剂。下图是某探究小组用含有MgCO3、MgSO4、Al2O3杂质的石灰石样品制取氯化钙的流程(所加入的试剂均为适量)。回答:

(1)氯化钙中钙元素的化合价为 。
(2)①中共发生了 个化学反应。
(3)②中除去的杂质离子是 。
(4)③中一个反应的化学方程式为 。
(5)滤渣的成分有氢氧化镁、 和 。
某校化学兴趣小组,在实验室里用二氧化锰和浓盐酸在加热条件下制取氯气并进行有关氯气性质的实验探究(如图所示)。

回答下列问题:
(1)从分液漏斗中加入的药品是 。
(2)从反应物的状态和反应条件考虑,装置A属于 型气体发生装置。
(3)若进入装置D中的氯气是纯净干燥的,则装置B的作用是 ,装置C中盛有的溶液是 。
(4)实验过程中,同学们看到装置D中“石蕊纸花”(用石蕊溶液染成的紫色的干燥纸花,下同)无明显变化,E中湿润的石蕊纸花先变红后褪色。对此,同学们产生了浓厚的兴趣,于是继续进行以下实验探究。
【查阅资料】Ⅰ.氯气(Cl2)是一种黄绿色的有毒气体,能溶于水(溶解性不大),并能与水反应:Cl2+H2O═HCl+HClO(次氯酸)。
Ⅱ.氯气溶于水所得的溶液成为氯水,氯水除了具有消毒作用,还具有漂白作用。
【提出问题】氯水中的什么物质具有漂白作用?
【提出猜想】猜想1:氯水中的H2O具有漂白作用。
猜想2:氯水中的HCl具有漂白作用。
猜想3:氯水中的HClO具有漂白作用。
猜想4:氯水中的Cl2具有漂白作用。
【实验探究】
实验操作 |
实验现象 |
结论 |
①将石蕊纸花放入水中 |
石蕊纸花
|
猜想1不成立 |
②将石蕊纸花放入 中 |
石蕊纸花变红但不褪色 |
猜想2不成立 |
③
|
石蕊纸花先变红后褪色 |
猜想3
|
【反思交流】①同学们一致认为,不用再做实验对猜想4进行探究,理由是:进行氯气性质的实验探究时,装置 (填装置序号)的现象已证明了Cl2不具有漂白作用。
②钱程同学认为,由于氯气在水中的溶解性不大,用实验装置F中的蒸馏水吸收氯气效果不是很理想,于是将装置F中的蒸馏水换成了氢氧化钠溶液,则最终反应所得溶液中含有的盐类物质是 。
某污水中除含有少量泥沙外,还含有Ca2+、Mg2+、Na+、Cl﹣、SO 等离子,为充分利用资源,科研小组设计了如下流程回收几种离子:
等离子,为充分利用资源,科研小组设计了如下流程回收几种离子:

(1)①②③④步骤均有一个相同的操作步骤;此操作步骤必须用到的玻璃仪器有:烧杯、玻璃棒、 ;
(2)沉淀B的化学式为 ;
(3)加入过量稀盐酸可除去的物质有 ;
(4)步骤③中反应的方程式为 .
Na2CO3和NaHCO3有很多相似的化学性质,例如它们都能与稀盐酸反应生成 气体。某学习小组对它们的鉴别方法产生了探究兴趣。
【提出问题】如何鉴别Na2CO3和NaHCO3呢?
【查阅资料】(1)NaHCO3固体受热分解生成碳酸钠和两种氧化物。
(2)Ca(HCO3)2可溶于水。
(3)通常状况下,NaHCO3是一种白色晶体,溶解度小于Na2CO3的溶解度,饱和的Na2CO3溶液中通入CO2气体,可生成NaHCO3。
【作出猜想】猜想一:可用酚酞溶液鉴别Na2CO3和NaHCO3溶液。
猜想二:可用加热的方法鉴别Na2CO3和NaHCO3固体。
猜想三:可用澄清石灰水鉴别Na2CO3和NaHCO3溶液。
猜想四:可用CO2气体鉴别Na2CO3和NaHCO3溶液。
小组同学一致认为猜想一不正确,理由是 。
【实验探究】请你与小组同学一起探究。
实验操作 |
实验现象 |
实验结论 |
|
实验1 |
分别取少量的Na2CO3和NaHCO3 固体于试管中加热,并将产生的气体通入澄清石灰水 |
加热Na2CO3时,澄清石灰水无变化;加热NaHCO3时,澄清石灰水变浑浊 |
|
实验2 |
分别取少量Na2CO3和NaHCO3溶液于试管中,加入澄清石灰水 |
两支试管中均产生了白色沉淀 |
猜想三 不正确 |
实验3 |
往盛有饱和Na2CO3和NaHCO3溶液的两支试管中分别通入足量的CO2气体 |
观察到 |
猜想四 正确 |
【问题讨论】
同学们对实验2的实验现象进行分析。从物质在溶液中解离出不同离子的微观角度分析,Na2CO3溶液与澄清石灰水发生反应的本质原因是 ,该反应的基本类型是 。石灰水与NaHCO3溶液也能反应生成白色沉淀,老师指出其反应原理较复杂,有待于今后学习中进一步探究。
【拓展应用】
除去固体Na2CO3中混有的少量NaHCO3,可用的方法是 (用化学方程式表示)。
课堂上,老师取20g蔗糖放入小烧杯中,加少量水使它润湿,注入10mL浓硫酸,搅拌,同学们看到蔗糖先变黑后“发酵”形成“黑面包”,同时还闻到了刺激性气味,同学们判断黑色固体是碳,原因是浓硫酸具有强 .
形成“黑面包”的主要原因是什么?在老师的指导下,同学们开展了探究活动.
【猜想与假设】浓硫酸与碳反应,生成大量气体使黑色固体膨胀.
【查阅资料】
Ⅰ.浓硫酸与碳在加热条件下反应,生成物中有SO2、CO2两种气体.
Ⅱ.SO2是一种具有刺激性气味的气体,能与Ca(OH)2溶液反应生成白色沉淀.
Ⅲ.SO2能使品红溶液褪色,而CO2不能.
【实验探究】
为验证碳与浓硫酸在加热条件下生成的气体产物,同学们在老师指导下设计并进行如图实验:

【事实与结论】
(1)请将能得出对应结论的实验现象填入表中.
验证气体 |
实验现象 |
实验结论 |
SO2 |
|
有SO2产生 |
CO2 |
|
有CO2产生 |
(2)碳与浓硫酸反应的化学方程式是 .
(3)浓硫酸与碳在加热条件下产生大量的SO2和CO2,使黑色固体膨胀,形成“黑面包”,猜想成立.
【反思与交流】
(1)小明同学提出,因老师的演示实验没有进行加热,所以同学们的探究实验无意义,其他同学一致否定了他的说法,理由是 .
(2)若B、E中试剂交换, (填“能”或“不能”)得出有CO2产生的结论,理由是 .
(3)C中酸性高锰酸钾溶液的作用是 .
氢氧化钾是一种常见的碱.某化学兴趣小组的同学依据绿色化学的核心及原则,利用所学的化学知识,设计了制备氢氧化钾的方案,同时还可制得纯碱等物质,具体流程如图所示(部分反应、条件和产物已经略去):

【提出问题1】溶液C中的溶质除氢氧化钾外,还含有什么?
【猜想与假设1】猜想1:K2CO3 猜想2:Ca(OH)2
【实验与探究1】小林同学设计了如下实验对猜想进行探究
实验操作 |
实验现象 |
实验结论 |
取少量溶液C于试管中,滴加稀盐酸 |
|
猜想1错误 |
同学们经过讨论分析后认为小林的实验结论不严密,理由是 .
【提出问题2】固体D中的成分是什么?
【猜想与假设2】小军同学经分析认为一定含有CaCO3,原因是 (用化学方程式表示);可能还含有 .
【实验与探究2】请你设计一个简单可行的实验方案,证明固体D中存在猜想与假设2中可能还含有的物质 (所用试剂只能为溶液).
【表达与交流】由反应①和反应②原理制备纯碱的方法就是我国著名的“侯氏制碱法”,请写出反应①的化学方程式 .
【反思与评价】请你写出以上物质制备流程方案中体现绿色化学的核心及原则的一点 .
孔雀石主要成分为Cu2(OH)2CO3 (难溶于水),还含有少量SiO2(难溶于水、不与稀硫酸反应)、Fe2O3等杂质。现以孔雀石为原料制取胆矾(CuSO4•5H2O)的部分工艺流程如图。
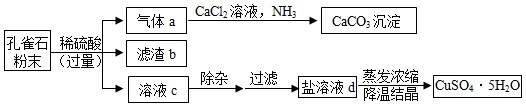
请回答:
(1)滤渣b的化学式为 。
(2)溶液c中的溶质有(写化学式):H2SO4、 、 。
(3)盐溶液d的颜色为 ;实验室蒸发溶液时用到的玻璃仪器有 (写1种)
(4)在气体a生成CaCO3的过程中,发生反应:CO2+CaCl2+2NH3+H2O=CaCO3↓+2X,X的名称为 ;孔雀石与稀硫酸反应生成气体a的化学方程式为 。
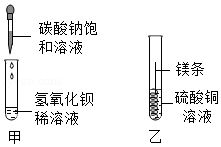
某同学进行如图两个实验:
(l)甲实验中反应的化学方程式为 ;
(2)乙实验观察到的现象是 ,溶液由蓝色变成无色
(3)把甲、乙反应后的溶液倒入同一烧杯,发现有白色沉淀生成。他决定对白色沉淀的成分进行探究。
[查阅资料]硫酸钡不溶于酸。
[提出猜想]白色沉淀为:Ⅰ. ;Ⅱ.Mg(OH)2和BaSO4;Ⅲ.Mg(OH)2和MgCO3。
[实验方案]
实验操作 |
实验现象与结论 |
过滤、洗涤白色沉淀备用;向白色沉淀中加入盐酸至过量 |
①若沉淀全部溶解,且无其它现象;猜想Ⅰ成立;其化学反应方程式为 。 ②若 且无气体产生,猜想Ⅱ成立。 ③若沉淀完全溶解, ,猜想Ⅲ成立。 |
[拓展与思考]如果猜想Ⅲ成立,产生此结果的原因是做甲实验时 ;上述白色沉淀的成分不可能出现的组合是Mg(OH)2、MgCO3和BaSO4,原因是 。
试题篮
()