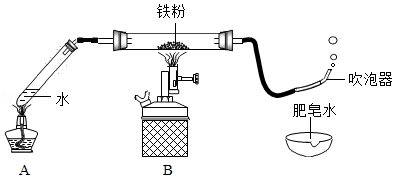
某班学生在老师指导下探究铁与水蒸气的反应。
(1)按如图装好药品、连好装置(夹持仪器已略去)。其中A装置的作用是 。
(2)加热一段时间后,灰色铁粉逐渐变黑,吹泡器连续吹出气泡,且气泡向上飞起;用燃着的木条靠近气泡,能产生爆鸣。该气体燃烧的化学方程式为 。
(3)同学们讨论后认为:铁与水蒸气反应生成的固体是“铁的一种氧化物”,玻璃管内的黑色固体中还可能含有“过量的铁”。
【查阅资料】铁有三种氧化物(FeO、Fe2O3、Fe3O4),其中FeO接触到空气会立即由黑色变为红棕色,铁的三种氧化物都不与硫酸铜溶液反应
【实验探究】
实验步骤 |
实验现象 |
实验结论 |
倒出玻璃管中黑色固体,平铺于白纸上 |
黑色固体不变色 |
黑色固体中一定没有 (填物质名称) |
取上述黑色固体少许,装入试管,加入足量 溶液 |
,且有红色固体出现 |
黑色固体中一定含有
|
【探究结论】铁与水蒸气发生置换反应,有关的化学方程式是
【拓展创新】同学们利用微型仪器“长柄V形玻璃管”改进了图甲装置,设计出图乙装置,并分别选用湿棉花、湿粉笔、芦荟叶、芭蕉茎、氢氧化镁、氢氧化铜等作为供水剂,实验都获得成功
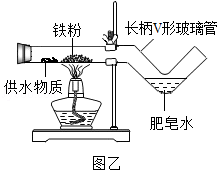
①甲、乙装置相比,乙装置有很多优点,请你写一条:
②分析上述供水剂的供水原理,其中正确的是 (填字母)
A.疏松、多孔的物质,有良好的吸水性和保水性能
B.新鲜的富水植物,在受热时水分容易释放出来
C.本身不含水的固体物质,不能用作供水剂。
实验探究和证据推理是提升认知的重要手段。化学兴趣小组对"CO还原Fe 2O 3粉末"的实验进行探究:
Ⅰ探究CO与Fe 2O 3的反应产物(夹持仪器已略去)
【实验过程】步骤1 在通风橱中,按图Ⅰ连接装置并检验装置的气密性。
步骤2 装入试剂:玻璃管内装入Fe 2O 3粉末,试管Ⅰ中装入澄清石灰水。
步骤3 从a端通入CO一段时间,待 ,再点燃酒精灯。
【实验现象】反应一段时间后,玻璃管内粉末由 色变成黑色,生成的黑色固体均能被玻璃管上方的磁铁吸引。试管Ⅰ中出现白色沉淀(用化学反应方程式表示: )。
【查阅资料】铁粉、FeO、Fe 3O 4均为黑色固体;铁粉、Fe 3O 4均能被磁铁吸引。
【提出猜想】对磁铁吸引的黑色固体成分有以下三种猜想:
猜测Ⅰ:Fe; 猜测Ⅱ:Fe 3O 4; 猜测Ⅲ:Fe和Fe 3O 4
【实验验证】取少量反应后的黑色固体放入试管中,加入足量的硫酸铜溶液,振荡,充分反应后静置,观察到红色固体中混有黑色颗粒,说明 (填"猜想Ⅰ""猜想Ⅱ"或"猜想Ⅲ")是正确的。
【拓展研究】进一步查阅资料,发现CO能溶于铜液[醋酸二氨合铜(Ⅰ)和氨水的混合液].因此可在装置Ⅰ后再连接下图装置Ⅱ,其目的是 ,装置Ⅰ、Ⅱ的连接顺序:b连接 (填"c"或"d")。
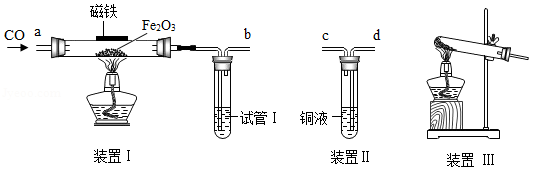
Ⅱ原料气CO的制备
方法一:加热MgCO 3、Zn的混合物可快速制备CO,同时还得到两种金属氧化物: 、 (填化学式)。
方法二:加热草酸晶体(H 2C 2O 4•2H 2O)制备CO:
H 2C 2O 4•2H 2O 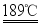 CO↑+CO 2↑+3H 2O
CO↑+CO 2↑+3H 2O
已知:常压下,草酸晶体的熔点为101℃.比较草酸晶体的熔点和分解温度,分析若选用图装置Ⅲ制备装置Ⅰ所需的CO,可能存在的问题是 。
兴趣小组的同学对碳酸氢钠、碳酸钠、氢氧化钠的某些性质进行相关探究。
【提出问题】它们溶液的酸碱性及与酸反应时溶液的pH如何变化?
【实验探究1】向等体积、等浓度的碳酸氢钠、碳酸钠、氢氧化钠溶液中,分别加入几滴紫甘蓝汁液,同时用蒸馏水进行对比实验,观察并记录现象如下:
| 液体名称 |
蒸馏水 |
碳酸氢钠溶液 |
碳酸钠溶液 |
氢氧化钠溶液 |
| 紫甘蓝汁液显示的颜色 |
蓝紫色 |
蓝色 |
绿色 |
黄色 |
查阅资料:
| pH |
7.5~9 |
10~11.9 |
12~14 |
| 紫甘蓝汁液显示的颜色 |
蓝色 |
绿色 |
黄色 |
【得出结论1】三种溶液的碱性由强到弱的顺序为 。
【实验探究2】甲同学在烧杯溶液中加入约5mL稀氢氧化钠溶液,滴入几滴酚酞溶液,此时溶液由 色变为 色。向其中加入稀盐酸,该反应的化学方程式为 。
乙同学向一定体积、一定浓度的氢氧化钠溶液中,逐滴加入一定浓度的盐酸,得到pH变化与时间的关系如图1所示。a点表示的意义是: 。
【得出结论2】从微观角度分析,该反应的实质是 。
【实验探究3】向等体积、含等碳原子数的碳酸氢钠和碳酸钠溶液中,分别逐滴加入一定浓度的盐酸,得到pH变化与时间的关系如图2、图3所示。
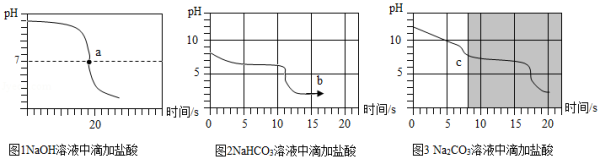
【交流与反思】b点的溶质为 (写化学式),将图2和图3的阴影部分进行叠加,发现两者基本重合,c点的溶质 (写化学式)
【得出结论3】通过上述分析,碳酸钠和盐酸反应过程,可以依次用以下两个化学方程式表示: 、 。
【结论与反思】探究溶液的酸碱性及反应pH值的变化,可以认识反应的原理及进行的过程。
"氧泡泡"系列产品去污能力强、绿色环保,已成为中国氧系清洁品类领导品牌,其主要成分是过碳酸钠(2Na 2CO 3•3H 2O 2)。某化学活动小组对过碳酸钠产生了浓厚的兴趣,决定对其进行探究。
【查阅资料】
Ⅰ.过碳酸钠在水中易离解成Na 2CO 3和H 2O 2,其水溶液具有Na 2CO 3和H 2O 2的双重性质;
Ⅱ.过碳酸钠与盐酸反应:2(2Na 2CO 3•3H 2O 2)+8HCl═8NaCl+4CO 2↑+3O 2↑+10H 2O;
Ⅲ.过碳酸钠的去污能力主要与其在反应中释放处的"活性氧"有关,"活性氧"含量越高,去污能力越强。
(1)20℃时,测得1%过碳酸钠水溶液的pH为10.5,说明其溶液呈 (选填"酸性"、"中性"或"碱性")。
(2)向过碳酸钠水溶液中加入少量MnO 2时产生大量气泡,发生反应的化学方程式是 。
(3)过碳酸钠样品中"活性氧"含量可按如下公式计算:
"活性氧"含量=  ×100%
×100%
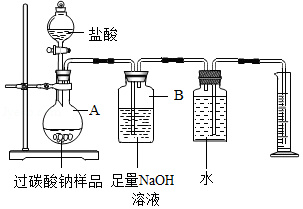
为测定某过碳酸钠样品中"活性氧"含量,取20g样品按如图实验装置与足量盐酸反应。(已知样品中杂质不溶于水且不与盐酸反应,装置气密性良好)
①将盐酸慢慢地入A中,反应一段时间,观察到 ,停止滴加盐酸。
②装置B可吸收生成的CO 2,该反应的化学方程式是 。
③甲同学认为若要得出生成氧气的质量,除要记录量筒内液体的读数外,还需要知道的数据是该实验条件下的 。
④将反应后A中所得溶液过滤、蒸发、结晶、烘干,称得固体质量为11.7g,乙同学据此计算出该过碳酸钠样品的"活性氧"含量,写出其计算过程。
⑤完成上述探究后,丙同学提出:称量反应前后装置B的质量,其质量差就是反应生成CO 2的质量,据此可计算出样品中"活性氧"含量。但丁同学认为该方案不合理,丁同学的理由是 (填写一条即可)
网传,84消毒液和粉状洁厕灵混合使用会产生有毒气体﹣氯气,这是真的吗?兴趣小组同学决定查阅资料并开展相关的验证实验.
(1)查阅后获知:这是真的,同时了解到氯气呈黄绿色,有毒,可溶于水,难溶于橄榄油,密度比空气大,能与水、碱溶液发生反应生成可溶性物质.
(2)在老师的指导下,同学们利用84消毒液和粉状洁厕灵混合制取氯气,请根据下列提供的仪器,选择并组装发生和收集装置,正确的连接顺序为 (用接口处字母填写).
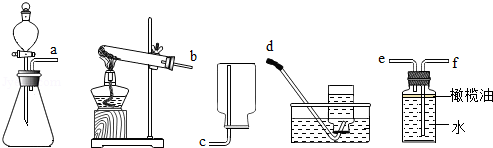
(3)同学们将收集到的黄绿色气体通入到装有几只蚱蜢的集气瓶中,并进行观察,他们这么做的目的是为了验证 .
(4)为了探究处理多余氯气的方法,取两个相同的装满氯气的软塑料瓶,分别标上A和B,向A瓶中倒入一定量的氢氧化钠溶液,向B瓶中倒入等量的水,充分振荡后,若观察到 现象,说明氢氧化钠溶液吸收氯气的效果更好.
一般不用K、Ca、Na等活泼金属来置换盐溶液中的其他金属元素,这是教科书上的一句话。小科对此进行了思考,并查阅资料,对金属钠和硫酸铜溶液的反应进行探究。
【查阅资料】钠常温下就能与水发生剧烈反应,反应方程式为:2Na+2H2O═2NaOH+H2↑
【提出猜想】猜想一:金属钠和硫酸铜溶液反应会有铜生成。
猜想二:金属钠和硫酸铜溶液反应,生成的沉淀只有氢氧化铜。
【实验及现象】切取不同大小的钠块分别投入到两种不同浓度的硫酸铜溶液中,有关产生沉淀的现象如表所示
实验编号 |
钠块大小 |
硫酸铜溶液 |
实验中产生沉淀的现象 |
① |
绿豆大小 |
稀溶液10mL |
产生蓝绿色沉淀 |
② |
绿豆大小 |
浓溶液10mL |
产生蓝色絮状沉淀 |
③ |
豌豆大小 |
稀溶液10mL |
产生蓝色絮状沉淀 |
④ |
豌豆大小 |
浓溶液10mL |
产生蓝色絮状沉淀,并出现黑色固体 |
小科咨询老师后得知蓝绿色沉淀为碱式铜盐。
【实验结论】(1)上述实验中均未观察到 色固体生成,由此判断猜想一错误。
(2)实验①中观察到的沉淀是蓝绿色的,由此判断猜想二也错误。
【实验反思】
(1)实验中生成氢氧化铜沉淀的原理是 。
(2)由上述实验可知,导致钠和硫酸铜溶液反应的产物不同的因素有 。
(3)为了用钠置换硫酸铜中的铜元素,小科设计了如下实验方案
方案一:把钠块和无水硫酸铜直接混合,在干燥的空气中加热。
方案二:把钠块和无水硫酸铜直接混合,隔绝空气加热。
请从两个方案中选出合理的方案,并说明理由。 。
科学兴趣小组的同学在学了俗称为苏打的碳酸钠后,得知它还有一个俗称为小苏打的"兄弟",这个"兄弟"的性质是否和它相似?它们之间能发生转化吗?
小明查阅了资料,将相关信息整理如表:
| 俗名 |
苏打 纯碱 |
小苏打 |
| 化学式 |
Na 2CO 3 |
NaHCO 3 |
| 构成微粒 |
Na + CO 3 2 ﹣ |
Na + HCO 3 ﹣ |
| 溶解度(常温) |
21.5克 |
9.6克 |
| 两者的转化 |
Na 2CO 3+CO 2+H 2O═2NaHCO 3 |
2NaHCO 3 |
下面是小明同学进行的探究:
(1)用试管取适量NaHCO 3溶液,向试管中滴加酚酞试液,观察试液颜色变化。此实验的目的是 。
(2)在研究Na 2CO 3与NaHCO 3转化时,小明觉得Na 2CO 3转化为NaHCO 3过程中,由于NaHCO 3溶于水,整个过程不会有明显现象。老师笑着对小明说:"做实验吧,实验会告诉你答案。"于是小明在老师的指导下,向饱和的Na 2CO 3溶液中通入CO 2,起初无明显现象,继续不断地通入CO 2,溶液中出现了白色沉淀。这让小明很疑惑:NaHCO 3溶于水,为什么还有白色沉淀呢?小明经过思考,明白了白色沉淀产生的原因是 。
(3)在小明同学的带动下,兴趣小组又对NaHCO 3的其他性质进行了探究,发现两"兄弟"既有相似的性质也有不同的个性。从微观角度分析,造成两"兄弟"不同个性的原因是 不同。
将光亮镁条放入一定量的稀HCl中,产生大量气泡后出现灰白色固体.某同学对该现象作如下探究.
(一)产生气泡反应的化学方程式 .
(二)过滤、洗涤、一定温度下烘干得灰白色固体.对灰白色固体作如下猜测并进行实验:
【猜测】
灰白色固体可能是:①剩余的Mg;②MgCl 2晶体;③Mg和MgCl 2晶体.
【实验】
1.取灰白色固体样品,加入稀HCl,无气泡产生,则猜测 (选填序号)不成立.
2.称取等质量的灰白色固体和MgCl 2晶体分别放入同温、等量水中,灰白色固体不溶解而MgCl 2晶体全部 ,则猜测②不成立.
查阅资料:Mg与MgCl 2饱和溶液反应可生成灰白色碱式氯化镁[Mg x(OH) yCl z],其不溶于水,能与酸反应.
3.取一定量的灰白色固体,溶于稀硝酸,将所得溶液分成两等份.
①向一份溶液中滴加过量的NaOH溶液,生成了1.160gMg(OH) 2沉淀;
②向另一份溶液中滴加过量的AgNO 3溶液,生成了1.435g沉淀;
证明AgNO 3溶液过量的方法:静置,向上层清液中滴加 溶液,无现象.
【结论】x:z= ,所得碱式氯化镁的化学式为 .
根据下列实验装置图,回答有关问题
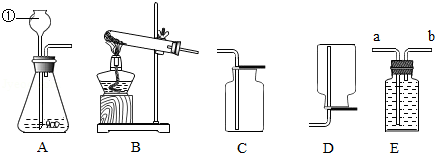
(1)图中标有①的仪器名称是 .
(2)实验室制取二氧化碳的化学方程式为 ,证明集气瓶已充满二氧化碳的方法是 ,集满二氧化碳的集气瓶应 (填"正"或"倒")放在桌面上.
(3)实验室加热氯酸钾和二氧化锰制取氧气的化学方程式为 ,其中二氧化锰起 作用,应选择的发生装置是 (填字母),若用盛满水的E装置收集氧气,应从导管 (填"a"或"b")处通入.
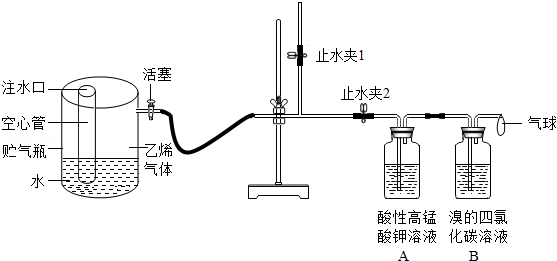
(4)小可同学为探究乙烯的化学性质,设计了如图所示的实验装置,已知:①乙烯是一种无色气体,具有可燃性;②乙烯能使酸性高锰酸钾溶液褪色;③乙烯能使四氯化碳溶液褪色.他的操作过程如下:关闭止水夹1.打开止水夹 2.打开活塞,观察到A、B中溶液均逐渐退至无色.关闭止水夹2.打开止水夹1.在尖嘴导管处点燃乙烯,发现火焰较微弱,说明尖嘴导管处乙烯量较少.待A、B中溶液均褪至无色后直接点燃乙烯的原因是 .于是,他关闭水夹1一段时间后,向贮气瓶中加水,说明乙烯 (填"难"或"易")溶于水.打开止水夹Ⅰ,重新点燃乙烯,观察到火焰明亮且有浓烟.他关闭止水夹1一段时间后才向贮气瓶中加水的原因是 .
利用如图1装置,小卫设计并实施了下列实验,(压强传感器用于测量抽滤瓶内压强变化:各数据均于同温下测定获得)

实验Ⅰ:再小试管中加入8mL溶质质量分数为3%的双氧水(ρ=1g/mL),在抽滤瓶中分别加入不同质量的MnO 2,使其反应并启动传感器,记录容器内压强变化于图2中。
实验Ⅱ:在抽滤瓶中加入0.1g MnO 2,在小试管中分别加入不同体积溶质质量分数为3%的双氧水,使其反应并启动传感器,记录容器内压强变化于图3中。
请根据以上实验回答下列问题:
(1)使容器内压强增大的反应的化学方程式: 。
(2)根据图2可发现,该实验条件下,30s内催化分解8mL溶质质量分数为3%的双氧水,MnO 2的最小用量为 g;
(3)根据图3可发现,0.1g MnO 2至少能快速催化分解 g过氧化氢;
(4)根据图2与图3可发现,MnO 2的用量总体上与O 2产量 (填"正相关"、"不相关"或"负相关"),根据图3还可发现,该试验中,O 2产量总体上与双氧水用量是 (填"正比"或"反比");
(5)下列因素中,与本实验所测数据的精确度有关的是
| A. |
反应容器的气密性 |
| B. |
称量MnO 2质量的精准度 |
| C. |
量取双氧水体积的精准度。 |
莫凡同学完成镁与稀盐酸反应的实验后,观察到有灰白色沉淀生成的"异常"现象,引起了他的兴趣,并进行了以下探究。
【初步探究】出现灰白色沉淀是否为偶然现象。
【实验Ⅰ】向4份相同体积与浓度的稀盐酸中分别加入一定长度的某种镁带,现象如下:
| 实验组别 |
A |
B |
C |
D |
| 镁带长度 |
1cm |
2cm |
3cm |
4cm |
| 沉淀量 |
无沉淀生成 |
少量沉淀 |
沉淀较多 |
沉淀很多 |
【实验结论】并非偶然,据表分析, 是实验出现"异常"的主要因素。
【再次探究】该沉淀的成分
【猜想假设】猜想1:Mg;猜想2:MgCl 2
【实验Ⅱ】
| 序号 |
实验操作 |
实验现象 |
实验结论 |
| ① |
取1g样品,加入足量 ,振荡 |
未见气泡 |
猜想1错误 |
| ② |
取1g样品,加入5mL蒸馏水,振荡 |
沉淀未溶解 |
猜想2错误 |
| ③ |
取1g MgCl 2固体,加5mL蒸馏水,振荡 |
固体全部溶解 |
【交流讨论】
(1)莫凡同学做出猜想Ⅰ的依据是他认为反应物Mg过量,作出猜想2的依据是他认为生成物MgCl 2 。
(2)从实验设计的角度讲,实验③的作用是 。
【深入探究】该沉淀的物质组成
【查阅资料】
灰白色沉淀的成分为碱式氯化镁,它存在多种组成,化学式可表示为Mg x(OH) yCl z•nH 2O[即每份Mg x(OH) yCl z结合了n份H 2O],它受热分解可产生氧化镁、氯化氢和水。
【实验Ⅲ】
洗去沉淀表面杂质并室温晾干,取其7.07g,用如图装置(夹持仪器未画出)按照正确的操作步骤进行实验,待反应停止后,测得硬质玻璃管中剩余固体质量为4.00g,装置B的质量增加了2.34g。
【问题讨论】
(1)反应停止后,应继续通入N 2一段时间,目的是 。
(2)该沉淀中,镁、氯的离子个数比n(Mg 2+):n(Cl ﹣)= 。
(3)若沉淀Mg x(OH) yCl z•nH 2O中,n=5,则X、Y、Z的数值依次为 。

某同学发现家里的铜质水龙头表面出现了一层绿色的锈渍,经查阅资料,了解到这层锈渍的化学成分是碱式碳酸铜[Cu 2(OH) 2CO 3],并对Cu 2(OH) 2CO 3受热完全分解后的产物进行探究。
【查阅资料】(1)碱式碳酸铜受热分解生成水蒸气、二氧化碳和一种黑色固体。
(2)白色无水硫酸铜遇水变成蓝色。
【提出猜想】该同学根据碱式碳酸铜的化学式对黑色固体产物作出以下猜想:
①可能是碳 ②可能是氧化铜 ③可能是碳和氧化铜的混合物。
他猜想的依据是 ,且碳和氧化铜都是黑色的。
【实验探究】实验Ⅰ:按如图进行实验,证明分解产物中有H 2O和CO 2(图中夹持装置省略)
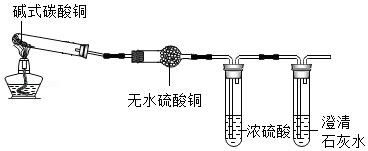
实验Ⅱ:为验证猜想,他做了如下实验:向盛有少量黑色固体的试管中加入足量的稀硫酸,振荡,待完全反应后静置,观察现象。
【实验分析及结论】
实验Ⅰ中:证明产物中有水生成的依据是 ;澄清石灰水变浑浊,产物中有 生成。
实验Ⅱ中:因为 且溶液变成蓝色,所以猜想②正确,故碱式碳酸铜受热分解的化学方程式为 。
通过上述实验及结论分析可知,铜质水龙头生锈过程中与水、二氧化碳、 有关。
【实验反思】为了防止铜质水龙头生锈,通常可采取的有效措施是 。
【拓展应用】依据碱式碳酸铜受热分解的产物及所学酸碱盐的知识,该同学认为可以用稀盐酸除去铜质水龙头表面的锈渍,反应的化学方程式为 。
某化学兴趣小组同学往NaOH溶液中滴加无色酚酞溶液时,发现溶液变成红色,可是过了一会儿红色消失,重新恢复为无色。于是该小组在老师指导下对这一现象进行了探究。
【提出问题】
溶液的红色为什么会变成无色呢?
【猜想与假设】
猜想一:可能是所用的酚酞溶液变质了。
猜想二:可能是NaOH与空气中的CO2反应了。
猜想三:可能是酚酞与空气中的O2反应了。
猜想四:可能是与NaOH溶液浓度大小有关。
【讨论交流】
小组同学集体讨论后认为猜想一 (填“合理”或“不合理”),原因是 。
【查阅资料】
对于猜想二,大家认为是错误的。如果是NaOH与空气中的CO2反应了,就会生成Na2CO3•Na2CO3俗称纯碱,查阅资料得知Na2CO3溶液呈碱性,pH约为10~11.9,能使酚酞溶液变红,且红色不会消失。
【设计并实验】
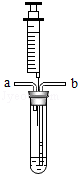
(1)为了验证猜想三,小组同学先往如图装有NaOH溶液的试管中,从b处通入密度比空气大的稀有气体,将试管内的空气排尽。然后通过注射器滴入无色酚酞溶液,观察到溶液变成红色,过一会儿红色仍然
消失。则猜想三 。(填“正确”或“错误”)
(2)为了验证猜想四,小组同学继续进行实验探究,并得出了实验结论,请你帮助该小组完成下表。
实验操作 |
实验现象 |
实验结论 |
猜想四是正确的。红色褪去变成无色是因为NaOH溶液浓度过大造成的。 |
【拓展延伸】
小组同学百度“酚酞”得知,酚酞(以H2In表示)其实是一种极弱的酸,遇碱溶液变红的变化可表示为:H2In(无色)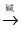 In2﹣(红色),据此信息写出H2In遇NaOH溶液变红的化学反应方程式 。
In2﹣(红色),据此信息写出H2In遇NaOH溶液变红的化学反应方程式 。
已知Na2SO4溶液pH=7.亚硫酸钠(Na2SO3)是种重要的化工原料,某实验小组对其性质进行如下探究:
(1)取1.0g亚硫酸钠固体于试管中,加入滴有酚酞的蒸馏水10mL,振荡。观察到固体逐渐溶解,溶液变红。据此现象你能得出亚硫酸钠的性质有 、 。将溶液分成两份。
(2)①取一份溶液滴加BaCl2溶液,观察到白色沉淀,该反应类型是 ,再滴加盐酸,沉淀溶解,并产生刺激味SO2,写出沉淀溶解的化学方程式 。
②取另一份溶液通入足量空气,观察到红色逐渐消失。小组猜想红色消失的原因可能是Na2SO3与O2发生了化合反应,该反应的化学方程式是 。请设计实验证明:向褪色后的溶液中滴加 ,观察到 ,则猜想合理。
为探究物质间的反应规律,化学兴趣小组的同学做了以下实验,每个实验最后都有一种叫复合肥的物质生成。推出符合a、b、c、d对应的物质是( )
①a+K2SO4→②b+K2O→③c+K2CO3→④d+KOH→
a |
b |
c |
d |
|
A |
Ba(NO3)2 |
HNO3 |
Ca(NO3)2 |
Mg(NO3)2 |
B |
Ca(NO3)2 |
HNO3 |
M(NO3)2 |
Ba(NO3)2 |
C |
HNO3 |
Ba(NO3)2 |
Ca(NO3)2 |
Mg(NO3)2 |
D |
Mg(NO3)2 |
HNO3 |
Ba(NO3)2 |
Ca(NO3)2 |
A.AB.BC.CD.D
试题篮
()