金属在日常生活,工农业生产和科学研究方面应用广泛.
(1)铜可用来制作导线,是因为其具有良好的延展性和 .
(2)在空气中,铝表面生成一层致密的氧化膜,氧化膜的主要成分是 .
(3)某实验小组为了探究影响金属与酸反应快慢的因素,进行如表实验
| 实验序号 |
实验过程 |
实验现象 |
| 1 |
镁粉和铁粉分别与5%盐酸反应 |
镁粉产生气体快 |
| 2 |
铁粉和铁片分别与15%盐酸反应 |
铁粉产生气体快 |
| 3 |
铁片分别与5%盐酸和15%盐酸反应 |
15%盐酸产生气体快 |
由此得出影响金属与酸反应快慢的因素有:
a: b: c:
(4)小明将一包铜粉和锌粉的混合物放入一定量的硝酸银溶液中,使其充分反应后过滤,得到滤渣和滤液.
①锌和硝酸银溶液反应的化学方程式是 .
②若滤液为蓝色,则滤液中一定含有的金属离子是 (写离子符号)
对比归纳是学习化学的重要方法。请你参与下列探究活动并回答问题。
【探究活动一】探究影响木炭燃烧剧烈程度的因素
|
木炭在氧气中燃烧比在空气中燃烧更剧烈,说明了影响木炭燃烧剧烈程度的因素是 。 |
【探究活动二】探究影响物质溶解性的因素
|
①同学们做了A试管和B试管的对比实验,发现 B试管中固体可溶,A试管中固体几乎不溶。该对比实验说明了影响物质溶解性的因素是 。 ②同学们又补充了C试管所示实验,他们想探究的影响因素是 。 |
【探究活动三】探究二氧化碳能否与碱溶液反应
|
①分别振荡三个软质塑料瓶,观察到塑料瓶变瘪 的程度由大到小的顺序为 。 ②对比A瓶与 瓶的实验现象,可证明二氧化碳能与氢氧化钠溶液发生反应。 |
金属与酸反应属于放热反应,其反应速率除受反应物的性质影响外,还受温度、酸的质量分数、固体表面积大小等因素影响。现探究酸质量分数对反应速率的影响,实验室提供秒表、图甲器材和颗粒均匀的锌粒、铁片、铜片、2%稀盐酸、4%稀盐酸、2%稀硫酸、碎冰、水等药品。
(1)请选择合适器材和药品,设计实验写出步骤(可配图说明)。
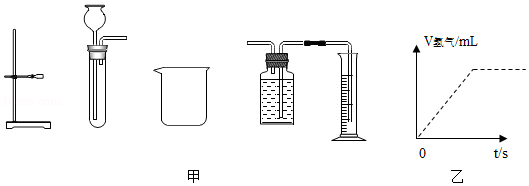
(2)实验结论:其他条件都相同时,酸的质量分数越大,反应越快。图乙是某资料中铁与2%稀硫酸在恒温条件下,生成氢气体积随时间变化的图象。请根据实验结论,对曲线进行适当的修改(在答题纸图乙上用实线画出),使其更合理。
实验室常用高锰酸钾制取氧气,可能用到的装置如图所示。
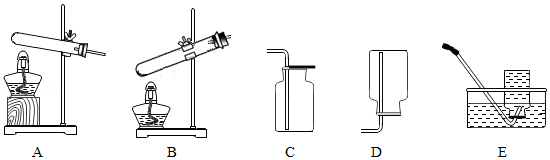
(1)本实验可选用的发生和收集装置为 (填字母)。
(2)①写出高锰酸钾分解制氧气的化学方程式: 。
②上述反应的理论产氧率为 [产氧率 100%,结果精确到0.1%]。
③取一定量的高锰酸钾固体,充分加热,发现实际产氧率远高于上述数值,则可能的原因有 (测定过程中产生的误差可忽略)。
(3)某同学进行该实验并用排水法收集O2.下列操作正确的是 (填字母)
a.未检查装置气密性即向大试管中加入高锰酸钾固体
b.当导管口有连续气泡均匀冒出时,开始收集氧气
c.集气瓶中氧气收集满后,先用玻璃片盖住集气瓶口,再将其移出水面
d.气体收集完毕后,先熄灭酒精灯,再将导管移出水面
(4)实验室也可用双氧水制氧气。某同学为研究MnO2粉末用量对双氧水分解速率的影响,做了以下实验:采用不同质量的MnO2粉末做催化剂,每次均用30mL 10%的双氧水(其他实验条件均相同),测定收集500mL氧气所用的时间,结果如表:
序号 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
MnO2用量/g |
0.1 |
0.2 |
0.3 |
0.4 |
0.5 |
0.6 |
0.7 |
0.8 |
0.9 |
所用时间/s |
17 |
8 |
6 |
3 |
2 |
2 |
2 |
2 |
2 |
①写出上述反应的化学方程式: 。
②该实验可得出的结论是 。
比较、推理是化学学习中常用的方法。下表是根据一些事实推导出的结论,其中推导不合理的是( )
序号 |
事实 |
结论 |
A |
碳的化学性质较稳定,氧气的化学性质较活泼 |
物质的组成和结构不同,其化学性质不同 |
B |
相同大小的镁片和铁片分别与相同浓度的盐酸反应,镁产生气泡的速度快 |
参加反应的物质的性质是决定化学反应快慢的重要因素 |
C |
4g氢氧化钠固体溶于46g水中得到50g溶液,溶液温度升高 |
物质发生化学反应有新物质生成,符合质量守恒定律,且伴随能量变化 |
D |
常温下过氧化氢分解速率缓慢,加入二氧化锰后迅速分解 |
化学反应有快有慢,通过改变条件可以调控反应的快慢 |
A.AB.BC.CD.D
将一定浓度的稀盐酸、稀硫酸分别加入装有等质量CaCO3粉末的容器中,相同条件下测得两者产生的CO2体积(V)与反应时间(t)的关系如图所示。下列判断错误的是( )
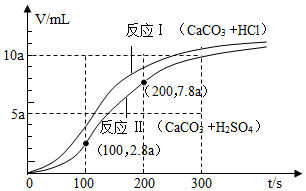
A.0~300s内,两个容器内溶液的pH均逐渐增大
B.0~100s内,反应Ⅰ、Ⅱ生成CO2的速率均先慢后快
C.反应Ⅱ中,0~100s内产生的CO2体积比100~200s内的少5a mL
D.实验室可以用一定浓度的稀硫酸与CaCO3粉末反应制备CO2
升温、增大浓度、加大压强和使用催化剂均可以提高化学反应速率。现把镁条投入盛有稀盐酸的试管中,试管外壁发烫。产生氢气的速率变化情况(v)和反应进行的时间(t) 的关系如图所示,则下列说法不正确的是( )
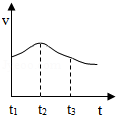
A.反应过程中溶液的pH逐渐增大
B.t1~t2速率变化的主要原因是反应物的量较多
C.t2~t3速率变化的主要原因是盐酸的浓度逐渐减小
D.t1~t2速率变化的主要原因是反应放热使溶液温度升高
某兴趣小组为探究影响化学反应速度的因素,使用等量的同种钙片和白醋开展四组实验,分别测得产生的二氧化碳浓度随时间变化曲线如图所示。选取CO2的浓度从0~8%为研究对象,下列实验结果的分析,错误的是( )

A.对比①③,温度越高,反应速率越快
B.对比②③,反应物接触面积越小,反应速率越慢
C.对比③④,反应物接触面积越大,反应速率越快
D.对比①②③④,④的反应速率最慢
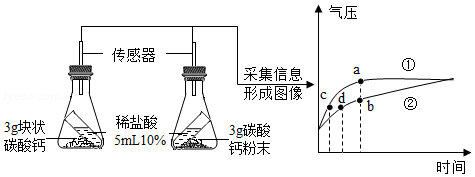
利用数据传感技术可以形象地比较不同形状的碳酸钙与稀盐酸反应的速率。某同学倾斜锥形瓶,使试管内的稀盐酸流入瓶中与碳酸钙发生反应,测得瓶内气压随时间的变化如图所示。
(1)碳酸钙与稀盐酸反应的化学方程式 。
(2)下列有关说法正确的是 (填字母序号)。
A.对比分析a、b点可知,曲线①表示块状碳酸钙与稀盐酸反应
B.对比分析c、d点可知,相同的气压时,碳酸钙粉末与稀盐酸反应速率更快
C.碳酸钙粉末产生的CO2质量多
某品牌加酶洗衣粉使用方法中提示:用温水浸泡。某科学兴趣小组对该加酶洗衣粉洗涤效果与水温之间的关系进行研究,每次实验所选的衣料、奶渍的量、洗衣粉的用量和用水量均相同。在不同水温条件下,测得这种加酶洗衣粉除去衣服上奶渍所需的时间,实验结果如下表所示:
水温(℃) |
30 |
40 |
50 |
60 |
70 |
80 |
除去奶渍所需的时间(秒) |
28 |
12 |
6 |
4 |
12 |
17 |
根据表中有关数据判断,能正确表示温度对该酶催化效率影响的图象是( )
A.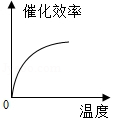 B.
B.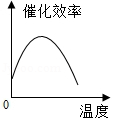
C.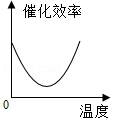 D.
D.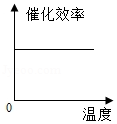
多种物质都可催化过氧化氢分解,如MnO2、CuSO4等。实验小组的同学探究漂白液(主要成分是NaClO和NaCl)、FeCl3、K2SO4能否催化过氧化氢分解。
(1)MnO2催化过氧化氢分解的化学方程式是 。
(2)如图所示,分别向三支试管中多次加入5%过氧化氢溶液,每次2mL,如有气泡产生,则将① 伸入试管,检验是否有氧气生成。结果如下表。

研究对象 |
第1次 |
第2次 |
第3次 |
第4次 |
漂白液 |
大量气泡 |
较多气泡 |
少量气泡 |
无气泡 |
FeCl3溶液 |
较多气泡 |
较多气泡 |
较多气泡 |
较多气泡 |
K2SO4溶液 |
② |
/ |
/ |
/ |
实验结论 |
ⅰ.实验中产生的气体都是氧气。(查阅得知:NaClO+H2O2═O2↑+NaCl+H2O) ⅱ.K2SO4不能催化过氧化氢分解。 ⅲ.③ 可能是过氧化氢分解的催化剂。 ⅳ.…… |
|||
(3)下列物质中,也可能是过氧化氢分解的催化剂的是 (填标号)。
A.CuCl2
B.Fe2(SO4)3
C.Na2SO4
D.KCl
(4)探究不同催化剂催化效果的实验方案:将等体积5%过氧化氢溶液加到不同催化剂中,比较用排水法收集50mL氧气的快慢。请从如图中选择合适的仪器(每种仪器限用一次),组成该探究的完整实验装置,不需要用到的是 。(填标号)。

小东同学模拟酸雨的形成过程进行了如下探究实验(已知SO2化学性质与CO2相似):①分别取等质量的硫粉在酒精灯上引燃后,伸入体积相同的甲、乙两个集气瓶中;②充分燃烧后,用玻璃片盖住集气瓶充分振荡,使生成的气体全部溶于水;③分别取其中一份大理石与其中一份反应后的溶液混合,反应开始时,下列哪种组合冒出气泡的速率最快( )
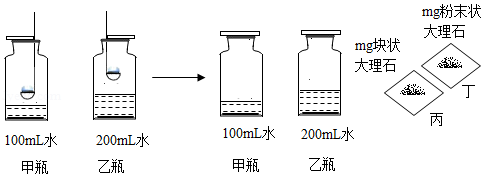
A.甲瓶溶液和丙B.甲瓶溶液和丁
C.乙瓶溶液和丙D.乙瓶溶液和丁
实验室可利用Zn与稀硫酸的反应制取H2。
(1)用浓硫酸配制稀硫酸的操作为 (填字母),用玻璃棒引流,并不断搅拌。
A.将浓硫酸缓缓注入盛有水的烧杯中
B.将水缓缓注入盛有浓硫酸的烧杯中
(2)Zn与稀硫酸反应的化学方程式为 。
(3)图1所示的仪器B、D的名称为 、 ,组装制取H2的发生装置应选用的仪器为 (填字母)。
(4)为收集并准确测量H2的体积,在装入药品前,需检查装置的 。
(5)相同条件下H2密度比空气小,利用该性质可以通过 法收集H2,若用图2所示装置测量生成H2的体积,H2应从 (填“甲”或“乙”)管通入。
(6)为探究影响Zn与稀硫酸反应快慢的因素,进行以下三组实验,室温下,取颗粒大小相同的锌粒与足量的稀硫酸反应,测量产生10mL H2(通常状况)所需的时间,下表为实验数据:
实验编号 |
硫酸的质量分数/% |
硫酸的体积/mL |
锌粒的质量/g |
时间/s |
1 |
10 |
10 |
1 |
78 |
2 |
10 |
10 |
2 |
57 |
3 |
40 |
10 |
1 |
9 |
①比较实验1、2的数据,可以得出的结论是 。
②由实验数据可知,该实验中对Zn与稀硫酸反应快慢影响较大的因素是 。
③比较不同条件下锌粒与稀硫酸反应的快慢有不同的方法,除测量产生相同体积的H2所需的时间,还可采用的测量方法是 (写出一种)。
某品牌加酶洗衣粉使用方法中提示:用温水浸泡。某科学兴趣小组对该加酶洗衣粉洗涤效果与水温之间的关系进行研究,每次实验所选的衣料、奶渍的量、洗衣粉的用量和用水量均相同。在不同水温条件下,测得这种加酶洗衣粉除去衣服上奶渍所需的时间,实验结果如下表所示:
水温(℃) |
30 |
40 |
50 |
60 |
70 |
80 |
除去奶渍所需的时间(秒) |
28 |
12 |
6 |
4 |
12 |
17 |
根据表中有关数据判断,能正确表示温度对该酶催化效率影响的图象是( )
A.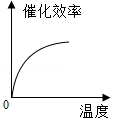 B.
B.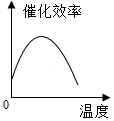
C.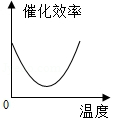 D.
D.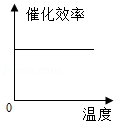
某化学兴趣小组为了探究氢气的实验室制法,进行了一系列实验探索。
(1)小组用锌和稀盐酸反应制取氢气,该反应的化学方程式为 。
(2)为了加快锌与稀盐酸的反应速率,老师提示了可向反应物中加入少量硫酸铜固体。为了弄明白速率加快的原因,小组同学提出了以下猜想。
猜想一:起促进作用的是硫酸根离子
猜想二:起促进作用的是铜离子
猜想三:生成物起到促进作用
为了验证上述猜想是否正确。
①小明将硫酸铜换成硫酸钠,发现反应速率几乎没有变化,小明得出猜想 不正确。
②小明提出将硫酸铜换成氯化铜进一步验证猜想,小刘认为不需要替换试剂,只需通过观察加入硫酸铜固体后的现象就可以验证,该反应的现象为 ,发生反应的化学方程式为 。此反应发生后速率加快依然较明显,小刘得出猜想 正确。
(3)小王觉得用稀硫酸比用稀盐酸制取的氢气更纯净,原因是 。
试题篮
()