某溶液可能含有盐酸、硫酸、硝酸钠、氯化铜中的一种或几种,为了探究其组成,向一定质量的该溶液中逐滴加入氢氧化钡溶液,生成沉淀的质量与所加氢氧化钡溶液的质量之间的关系如图所示,下列相关说法正确的是( )

| A. |
加入氢氧化钡溶液至过量,共发生了三个化学反应 |
| B. |
该溶液一定含有盐酸、氯化铜,可能含有硝酸钠 |
| C. |
反应过程生成的沉淀一定有氢氧化铜,可能有硫酸钡 |
| D. |
到达b点时所消耗氢氧化钡溶液中溶质的质量是17.1g |
小明发现某食品包装袋中有一个小袋,上面标有“成分:生石灰、铁粉;作用:防潮、防氧化”等字样。他想了解袋内粉末是否已失效,取少量粉末在水中充分溶解,滴入无色酚酞发现不变色。通过查阅资料获知,常温下铁在空气中不能反应生成Fe3O4和FeO,于是对粉末成分做出如下猜想:
猜想一:可能是CaCO3和Fe;
猜想二:可能是CaCO3和Fe2O3;
猜想三:可能是 。
【实验设计】小明设计了如图所示的实验:
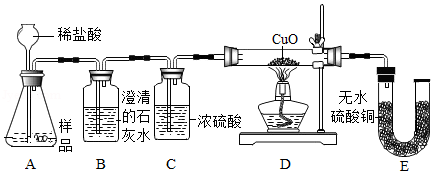
【实验与分析】
(1)向A装置中加入稀盐酸,B装置中出现浑浊现象,证明样品中含有CaCO3。
(2)若粉末中含有Fe,装置E中应观察到的现象是 。
【评价与反思】
上述实验中,如果将E装置去掉,是否还能验证粉末中含有Fe,请说明理由 。
某化学兴趣小组用如图装置验证一氧化碳还原氧化铜,并探究其还原产物的组成.

(1)装置及反应原理探究
①B装置中浓硫酸的作用为 .
②说明CO能还原CuO的现象为 .
③上述整套装置中发生的化学反应,其中属于化合反应的化学方程式 .(不考虑CO 2和H 2O的反应.)
(2)产物成分探究
【查阅资料】Ⅰ、一氧化碳还原氧化铜.除生成铜外还可能生成氧化亚铜(Cu 2O)
Ⅱ、Cu 2O为不溶于水的红色固体
Ⅲ、Cu 2O+H 2SO 4═Cu SO 4+Cu+H 2O
【提出问题】红色固体含有什么物质?
【猜想假设】假设一:红色固体只含Cu
假设二:红色固体只含Cu 2O
假设三: .
【实验验证】该小组为验证上述假设,取少量红色固体,加到足量稀硫酸中,观察到溶液变为蓝色,红色固体部分溶解.
【实验结论】根据上述实验结果,可知红色固体中一定含有 .
【数据处理】为进一步确定红色固体的成分,甲、乙两同学分别称取各自实验后的一定质量的红色固体,加到足量稀硫酸中使其充分反应,经过滤、洗涤、干燥后,称量剩余红色固体质量如表,请完善表中内容.
| 实验人员 |
红色固体(g) |
剩余红色固体(g) |
实验结论 |
| 甲 |
7.2 |
3.2 |
|
| 乙 |
4.08 |
2.48 |
|
【交流与反思】只要假设合理,方法正确,根据实验现象和数据就能得出结论.
现有一包固体粉末,可能是由CaCO3、Na2CO3、Na2SO4、NaCl、Ba(NO3)2中的一种或几种组成。为确定其成分,进行下列实验(微溶物质按可溶处理)。
①取少量固体粉末于试管中,加足量的水溶解,静置后得到白色沉淀A和无色溶液B;
②过滤,将白色沉淀A放入试管中,滴加过量的稀硝酸,有气泡产生,沉淀部分溶解;
③取无色溶液B少许于试管中,滴加过量的稀硝酸,有气泡产生,得到溶液C;
④在溶液C中滴加硝酸银溶液,有白色沉淀产生。
以下说法正确的是( )
A.白色沉淀A的成分是BaSO4和CaCO3
B.该固体粉末中乙一定有CaCO3、Na2SO4、Na2CO3和Ba(NO3)2
C.无色溶液B中的溶质一定有NaNO3、Na2CO3和NaCl
D.该固体粉末中一定有Na2SO4、Ba(NO3)2和Na2CO3,可能有CaCO3和NaCl
娄底人在端午节有吃皮蛋的习俗。某化学小组的同学查阅资料后得知,腌制皮蛋的主要原料有:生石灰、纯碱和食盐。同学们向这三种物质中加入适量水,充分搅拌,过滤,对滤渣中溶质的成分进行探究。
小组同学讨论后一致认为,滤液中的溶质一定含有NaCl和 。(写化学式)
【提出问题】滤液中还可能含有哪些溶质呢?
【作出猜想】
小林认为:还含有Ca(OH)2
小方认为:还含有Na2CO3
小华认为:还含有Ca(OH)2和Na2CO3
【交流讨论】经过进一步讨论,大家认为小华的猜想不合理,原因是: 。(用化学方程式表示)
【实验探究】
实验操作 |
实验现象 |
实验结论 |
小林:取少量滤液于试管中,滴加足量的稀盐酸 |
|
小方的猜想正确 |
小方:取少量滤液于试管中,滴加 溶液 |
产生白色沉淀 |
小方的猜想正确 |
小华:取少量滤液于试管中,滴加Na2CO3溶液 |
无明显现象 |
小方的猜想正确 |
【交流谈论】同学们认为,通过小华的实验不足以得出其结论,原因是 。
【继续探究】小明也取少量滤液于试管中,滴加稀盐酸,却没有看到明显现象,小明对此深感疑惑。
【解释评价】经老师的指导和大家的认真思考后终于找出了原因,你认为是 。最后,老师对同学们这种严谨的科学态度给予了充分的肯定。
某兴趣小组为探究锡纸中的金属成分(锡纸中以一种金属为主,其它成分对实验无干扰),开展了以下探究活动。
【提出问题】锡纸中的金属是什么?
【建立猜想】根据锡纸有银白色金属光泽,并结合金属活动性、价格等因素,猜想其中的金属可能是锌、铁、铝、锡中的一种。
【探究过程】
步骤 |
活动内容 |
收集证据 |
分析并得出结论 |
步骤一 |
①查阅资料:金属锌在室温下很脆 |
锡纸未破损 |
锡纸中金属不是锌 |
②取锡纸反复折叠 |
|||
步骤二 |
用磁铁靠近锡纸 |
锡纸没有被磁铁吸引 |
锡纸中金属不是 |
步骤三 |
①取锡纸条放入浓度为20%的盐酸中除去可能存在的氧化膜。当观察到 现象时,取出锡纸条并用蒸馏水清洗。 ②将处理过的锡纸条放入试管中,加入饱和硫酸锌溶液,静置观察。 |
②中锡纸条表面无明显现象 |
说明锡纸中的金属活动性比锌弱,则锡纸中金属不是铝,而是锡。 |
【交流评价】
小科对实验结论提出质疑:“无明显现象”并不代表没有发生反应,因为铝与硫酸锌反应[2Al+3ZnSO4=3Zn+Al2(SO4)3]生成的金属锌为银白色,与铝颜色相同,因此无法得出结论。请在不改变反应原理的前提下运用定量方法完善实验方案,并根据预期结果得出相应结论: ;
。
【继续探究】运用完善后的方案进行实验,分析实验结果,得出初步结论:锡纸中金属是铝。
已知某固体样品A可能是NH4NO3和MgCO3或两者之一,另有一固体样品B,其中可能含有Na2SO4,BaCl2,CuSO4、KCl四种物质中的一种或多种.按如图所示进行探究实验,出现的现象如图中所述(设过程中所有发生的反应都恰好完全反应).

试根据实验过程和发生的现象,填写以下空白:
(1)将气体C通入紫色石蕊试液,试液变 色.
(2)沉淀F的化学式为 .
(3)溶液D中,一定存在的阳离子是 (填写离子符号).
(4)写出步骤③中生成沉淀I的化学方程式 .
(5)在溶液H中,肯定存在的阴离子有 种.
(6)固体样品B中,一定不存在的物质是 (填写化学式),得出此结论的理由是: .
某未知溶液,可能含有Na+、Cu2+、Ba2+、SO42﹣、Cl﹣中的几种。为确定溶液中含有的离子,实验如下:
①取未知溶液2~3mL于试管中,滴加足量BaCl2溶液,有白色沉淀生成,静置;
②取①中上层清液,滴加AgNO3溶液,有白色沉淀生成;
③另取未知溶液2~3mL于试管中,滴加NaOH溶液,有蓝色沉淀生成。
分析实验过程,回答:
(1)溶液中一定存在的离子是 ;
(2)溶液中一定不存在的离子是 ;
(3)溶液中可能存在的离子是 。
有一瓶气体,可能由O2、CO、CO2中的一种或几种组成为确定其组成,在老师的指导下,实验小组对该瓶气体进行了如下探究:
【查阅资料】脱氧剂(还原铁粉能够吸收氧气和水蒸气)。
【实验设计】用如图所示的装置进行实验(已略去夹持装置)。

【实验步骤】①检查装置气密性;②通入一定量氮气;③通入该气体,点燃酒精灯。
【实验现象】步骤③实验过程中,A装置无现象,B和F装置出现白色沉淀,E装置中出现光亮的红色物质。
【实验结论】该气体由 组成。
【实验反思】
(1)C装置的作用是 。
(2)步骤②通入一定量氮气的目的是 。
(3)E装置中氧化铜粉末发生反应的化学方程式为 。
小明在冬天输液时发现护士在输液管上加了一个如图所示的装置,护士告诉他这是一次性输液加热棒,可以消除药液温度与体温的差异。加热棒里的成分到底是什么呢?科学研究小组通过上网查阅资料发现:一次性输液加热棒内的主要成分是还原性铁粉、炭粉和氯化钠等物质。该加热棒内是否真的含有这几种物质呢?科学研究小组设计了如下实验:

(1)探究加热棒内是否含有氯化钠
①将加热棒内的物质放入烧杯中,加入足量的水充分溶解、过滤,得到滤渣和滤液。
②取适量滤液于试管中,滴加适量的硝酸钡溶液和稀硝酸,无明显现象,
(填写正确的实验操作及现象),证明滤液中含有Cl﹣。
在老师的指导下通过进一步的实验证明滤液中还含有Na+,从而确定含有氯化钠。
(2)探究加热棒内是否含有铁粉
小明用磁铁靠近滤渣,发现部分黑色粉末被吸引。但被吸引的黑色物质也有可能是四氧化三铁。
小明通过如图装置探究黑色物质是否含有四氧化三铁,该物质鉴定的原理是:Fe3O4+4H2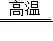 3Fe+4H2O。
3Fe+4H2O。

当观察到 这一现象时,排除了四氧化三铁存在的可能性。
小英同学认为这还不能确定铁粉的存在,因为除了四氧化三铁外,钴粉、镍粉也是能被磁铁吸引的黑色粉末。研究小组的同学在查阅资料的基础上,进行如下实验:取适量被吸引的黑色物质于试管中,加入足量的稀盐酸,充分反应后,向试管中加入足量的过氧化氢溶液(能将Fe2+转化为Fe3+),然后滴加硫氰化钾溶液。溶液变为血红色,证明溶液中有Fe2+,得出加热棒中含有铁粉这一结论。
(3)探究加热棒内是否含有炭粉
点燃不能被吸引的黑色粉末,并将产生的气体通入足量澄清石灰水,石灰水变浑浊,得出加热棒内含有炭粉这一结论。请写出此操作过程中确认炭粉存在的化学方程式: 、 。
综合上述实验,小明验证了加热棒内的主要成分。
加热棒为什么能够起到加热作用呢?小明还将进一步探究。
某同学为探究碳在氧气中不完全燃烧的气体产物中,既可能有一氧化碳,又可能有二氧化碳,他设计了如图所示实验:
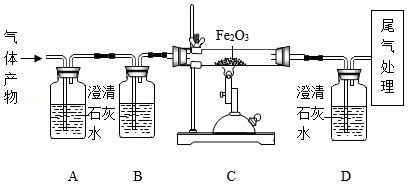
(1)装置A的作用是 。
(2)实验过程中,观察到装置C中玻璃管里的红棕色粉末逐渐变黑,说明原气体产物中含有一氧化碳,反应的化学方程式是 。
(3)通过观察装置D中澄清石灰水变浑浊,也能验证原气体产物中一氧化碳的存在,则装置B中应选择的试剂是 。
A.足量的氢氧化钠浓溶液
B.浓硫酸
C.水
(4)写出尾气处理的一种方法: 。
如图所示,某实验小组的同学在进行酸碱中和反应的实验时,向烧杯中的氢氧化钠溶液加入稀盐酸一会后,发现忘记了滴加指示剂。因此,他们停止滴加稀盐酸,并对烧杯内溶液中的溶质成分进行探究。
Ⅰ、从微观角度分析,中和反应的实质是 。
Ⅱ、探究烧杯内溶液中溶质的成分:
【提出问题】该烧杯内溶液中的溶质是什么?
【猜想】猜想①:可能是NaCl和NaOH;
猜想②:可能只有NaCl;
猜想③:可能是 。
【查阅资料】氯化钠溶液呈中性。
【进行实验】
| 实验方案 |
实验操作 |
实验现象 |
实验结论 |
| 方案一 |
取少量烧杯内溶液于试管,滴入几滴酚酞溶液,振荡 |
溶液 色 |
猜想①不正确 |
| 方案二 |
取少量烧杯内溶液于另一支试管 中,逐滴加入碳酸钠溶液至过量 |
|
猜想②不正确,猜想③正确 |
方案二发生反应的化学方程式是 。
【反思与拓展】
(1)在分析化学反应后所得物质成分时,除考虑生成物外还需考虑 。
(2)根据所学化学知识,验证烧杯内溶液中的溶质含有HCl,除以上方案外,下列哪些物质单独使用也能完成该实验? (填序号)。
A.pH试纸
B.铜
C.紫色石蕊溶液

某固体粉末可能含有氯化镁、硫酸钠、硝酸钠、硫酸铜和碳酸钙中的一种或几种,为确定其成分,某化学实验小组同学进行了如下实验。
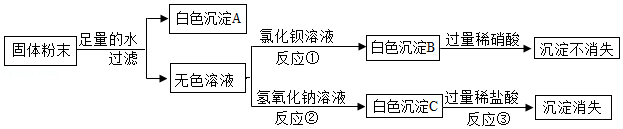
回答下列问题:
(1)白色沉淀C是 (填化学式)。
(2)反应①的化学方程式为 。
(3)原固体粉末中一定含有的物质是 (填化学式),一定不含的物质是 (填化学式)。
某固体粉末可能含有KOH、K2CO3、K2SO4中的一种或几种,为了确定其成分,进行如下实验: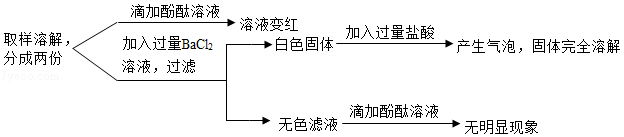
根据上述实验,回答下列问题:
(1)上述实验中,“产生气泡”的化学方程式为 。
(2)分析实验现象,推断原固体粉末的成分是 (填化学式)。
(3)能区别K2CO3溶液和NaCl溶液的试剂是 (填标号)。
A.NaOH溶液
B.盐酸
C.酚酞溶液
D.NaNO3溶液
试题篮
()