实验室处理一批过期的化学药品,兴趣小组同学决定对一癣已经结块的氢氧化钠样品展开探究,请你参与。
[探究活动一]证明变质的样品仍然有氢氧化钠存在
资料摘要:碳酸钠的水溶液呈碱性,氯化钠、氯化钙的水溶液呈中性。
(1)氢氧化钠暴露在空气中发生变质反应的化学方程式为 。
同学们按照如下所示的步骤进行实验:
(2)步骤②中加入过量的氯化钙溶液的目的是 ;固体A必定含有的物质是 (写化学式)。
(3)“后续实验”验证氢氧化钠的存在,请你简述实验步骤和产生的现象: 。
[探究活动二]测定样品中碳酸钠的质量分数
取5.3g样品与足量的稀硫酸反应,测量生成二氧化碳的体积,从而计算出碳酸钠的质量分数。实验装置如图(不考虑其他因素的影响,装置的气密性良好):
(4)倾斜锥形瓶使样品与稀硫酸充分接触。写出甲装置中发生反应的一个化学方程式: 。
(5)量气管中水面上要加一层植物油(二氧化碳不溶于该油层),目的是 。
(6)实验测得的部分数据如下表所示:
| |
反应前 |
反应后 |
| 量气管内液面对应的刻度 |
42mL |
262mL |
根据表中的实验数据计算,反应生成的二氧化碳体积为 mL,已知在实验条件下,二氧化碳的密度为2g·L-1,则生成二氧化碳的质量为 g。
(7)通过计算,样品中碳酸钠的质量分数为 。
实验室有一瓶存放很久的氢氧化钠,李明同学认为可能变质了,到底是全部变质还是部分变质,同学们进行了探究。请你和他们一起完成以下实验探究。
同学们的猜想有:
猜想1:全部变质为碳酸钠;
猜想2:部分变质,既有氢氧化钠又有碳酸钠;
猜想3:没有变质,还是氢氧化钠。
李明小组的实验和推断:
| 实验步骤 |
实验现象 |
结论或解释 |
| 1、取少量样品于试管中,加入 少量 。 |
有气泡产生 |
化学方程式 猜想3不成立 |
| 2、取少量样品于试管中,加水形成溶液,再加入足量的氢氧化钙溶液。再取上层清液,加入 。 |
产生白色沉淀 溶液呈现红色 |
猜想2成立 |
反思与评价:张亮小组同学认为李明小组得出的“猜想2成立”的结论不正确,请你分析其原因 (用化学方程式表示),改进措施是 (也用化学方程式表示)
与
溶液反应,除生成一种盐外,还有气泡产生。为确定气体的成分,进行下列实验探究:
【假设与猜想】气体可能是
,
,
中的一种或几种。
【查阅资料】
①
②N
③
【实验探究】
(1)为确定是否含有
,将气体通入酸化的溶液中,无沉淀产生,则该气体中无
。
(2)为了探究其他气体是否存在,又设计了如下实验装置:
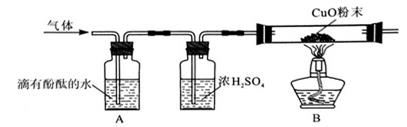
①A中观察到,证明有
;
②B中玻璃管内观察到证明有
;
③浓硫酸的作用是。
【实验结论】
与
溶液反应生成盐,
和
。写出化学方程式。
【实验反思】综合以上信息和实验结论,有同学认为不需要单独检验
,就能证明
不存在。请评价这种说法是否合理(填"是"或"否"),理由是。
在浓硫酸的催化作用下,固体草酸(
)受热分解生成碳的氧化物和水。某化学课外兴趣小组对生成物中碳的氧化物种类进行了如下实验探究:
【提出问题】生成物中有哪几种碳的氧化物?
【猜测】
| 猜想1 |
猜想2 |
猜想3 |
| 只有 | 只有 | 含有 和 |
【设计实验】基于猜想3,依据
和
的性质,兴趣小组同学设计了如下实验:

【实验探究】
(1)观察到装置(填序号)中的澄清石灰水变浑浊,证明草酸分解有
气体生成。
(2)有两种实验现象都能分别证明草酸分解的气体中含有
:
①
装置中澄清石灰水不变浑浊,
装置中;
②
装置中出现的现象。
【实验结论】通过实验探究证明:猜测3成立。
草酸分解的化学方程式是。
【问题讨论】
(1)
装置的作用是;
装置的作用是。
(2)装置末端酒精灯的作用是。
碲(
)被誉为"现代工业、国防与尖端技术的维生素,创造人间奇迹的桥梁"。实验室模拟提取碲的一个实验是:取某含碲溶液于烧瓶中,加入适量
,加热到一定温度,持续通入
,待反应一定时间,过滤得到粗碲。
(1)反应的总化学方程式为:

则X为(填化学式)。
(2)为探究获得较高粗碲沉淀率的反应条件,某研究小组在控制
浓度和
流量不变的条件下,进行下述对比试验,数据如下:
| 实验 |
温度/℃ |
反应时间/h |
粗碲沉淀率/% |
| a |
65 |
3.0 |
65.0 |
| b |
80 |
3.0 |
98.9 |
| c |
80 |
2.0 |
98.9 |
| d |
90 |
2.0 |
97.0 |
①该小组研究的反应条件是和。
②实验a和b 的目的是。
③在上述四组实验中,最佳的反应条件是
某兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验。
(1)请写出镁条与氧气反应的化学方程式。
(2)小明发现燃烧产物的质量大于反应物镁条的质量,认为这个反应不遵守质量守恒定律。
我("同意"或"不同意")小明的观点,因为。
(3)小红按下图装置改进实验,验证了质量守恒定律,却发现产物中还有少量黄色固体。

【提出问题】黄色固体是什么呢?
【查阅资料】
①氧化镁为白色固体
②镁能与氮气反应生成黄色的氮化镁(
)固体;③氮化镁可与水剧烈反应产生氨气,该气体能使湿润的红色石蕊试纸变蓝。
【做出猜想】黄色固体为
【实验探究】请设计实验,验证猜想
| 实验操作 |
实验现象及结论 |
【反思与交流】空气中
的含量远大于
的含量,而镁条在空气中燃烧生成的氧化镁却远多于氮化镁,为什么?请给出合理的解释。
(4)该兴趣小组又做了镁条与盐溶液反应的实验,发现均能产生
,实验现象如下:
| 实验序号 |
实验1 |
实验2 |
实验3 |
|
| 与镁条反应的溶液 |
|
|||
| 实验现象 |
有大量气泡产生 |
有较多气泡产生 |
有少量气泡产生 |
气泡较少 |
| 加热后,实验现象 |
气泡明显增多, 可闻到氨味 |
气泡增多 |
气泡增多 |
气泡增多 |
上表中,用水进行实验的目的是。
根据上表中的实验现象,请写出三条结论,并分析可能的原因(不分析原因,不得分)
①②③
为比较相同浓度的
溶液和
溶液对
分解的催化效果,某研究小组进行了如下探究:

(1)请写出
分解的化学方程式。
【定性探究】
(2)如图甲,可通过观察来定性比较两者的催化效果。
【定量探究】
(3)如图乙,实验前检查该装置气密性的方法是。要定量比较两者的催化效果,可测量生成等体积气体所需的。
【深入探究】
(4)在
溶液中,究竟是哪种离子起催化作用呢?
猜想1:铁离子(
)起催化作用;
猜想2:起催化作用;
猜想3:起催化作用;
……
请设计实验,验证猜想1
| 实验操作 |
实验现象及结论 |
某校化学兴趣小组参观制碱厂后,获得以下信息并对相关问题进行研究.
【查阅资料】
①生产原料粗盐中含有少量可溶性杂质(MgCl2和CaCl2)及不溶性杂质(不与酸反应).
②生产原理反应:NaCl+ NH3 + CO2 + H2O= NaHCO3↓+ NH4Cl,分离得晶体B,并使其充分受热,可分解制得纯碱,同时得到二氧化碳和水.
③氯化铵分解的化学方程式是NH4Cl △ NH3↑+HCl↑.
④部分生产流程如下图所示:
【问题讨论】
(1)①溶液A中的溶质有NaCl和 、 ,
②操作Ⅱ的名称为 .
③流程中Na2CO3溶液的作用是除去粗盐中的 .
④写出加入NaOH溶液与MgCl2反应的化学方程式 .
⑤晶体B受热分解的化学方程式为 .
(2)上述生产流程中可循环使用的是 (填序号).
A.NaOH B.NH3 C.HCl D.CO2
【组成探究一】
(3)设计实验检验纯碱样品中是否混有晶体B,请完成下表
| 选择的装置 |
实验现象 |
实验结论 |
| |
|
|
| 选择的装置(填序号) |
实验现象 |
实验结论 |
| |
|
样品不含晶体B |
【组成探究二】
(4)取纯碱样品加水溶解,向该溶液中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀.产生沉淀的方程式为 ,由此确定纯碱样品含有杂质NaCl.
【组成探究三】
(5)同学们为了测定该纯碱样品的纯度,设计了如下实验:
①判断加入氯化钙溶液是否过量的方法是 ,然后观察现象判断.
②判断滤渣是否洗涤干净,可以采取向最后的洗出液中滴加 ,然后观察现象判断.
A.氯化钡溶液 B.硝酸银溶液 C.碳酸钠溶液 D.稀盐酸
③根据实验数据,计算样品中碳酸钠的质量分数是多少?(写出计算过程.3分)
在化学实验技能考试中,有一题目是鉴别碳酸钠溶液和氢氧化钠溶液,小红等几位同学进行了如图所示的实验。
(1)写出试管②中碳酸钠与氢氧化钙反应的化学方程式: 。
(2)实验结束后,小红同学将①、②两支试管中的废液倒入同一个干净的烧杯中,看到废液浑浊,就对废液进行了过滤,小红等几位同学对滤液的成分又进行了探究。
【提出问题】滤液中除水外还含有哪些物质?
【猜想】小红认为:只含氢氧化钠;小明认为:可能含有氢氧化钠、碳酸钠和氢氧化钙;
小亮认为:可能含有氢氧化钠和碳酸钠;你认为还可能是 (写一种猜想)。
【讨论】你认为小红、小明、小亮三位同学中谁的猜想不合理,请说明理由: 。
【实验设计】设计一个简单的实验证明你的猜想正确。
| 实验步骤 |
实验现象 |
实验结论 |
| 取样于试管中, |
|
你的猜想正确 |
【实验分析】小亮同学针对自己的猜想进行了如下实验:
| 实验步骤 |
实验现象 |
实验结论 |
| 取样于试管中,滴入几滴稀盐酸 |
没有气泡产生 |
自己的猜想不成立 |
你认为小亮同学对实验结果判断是否正确?请说明理由: 。
【反思拓展】在分析化学反应后所得溶液中溶质的成分时,除考虑生成物外还需考虑 。
在一次化学实验探究活动中,老师给某学习小组一瓶由碳酸钠溶液与澄清石灰水混合反应后,并经过滤得到的无色滤液,要求对该无色滤液中溶质的成分进行探究,请你一同参与他们的探究活动。
【提出猜想】滤液中溶质的成分有如下几种可能:
| A.NaOH |
| B.Na2CO3、Ca(OH)2、NaOH |
| C.Na2CO3和NaOH |
| D. 【讨论交流】(1)上述猜想中,肯定不成立的一项是(填猜想序号),其理由是; (2)某同学取少量溶液于试管中,滴加过量稀盐酸,发现无气泡产生,说明是不成立的(填猜想序号)。 (3)为了进一步确定溶液的成分,同学们设计实验方案,写出实验步骤以及预期现象与结论 实验步骤 预期现象及实验结论 |
常温下没有氧气存在时,铁与水几乎不反应,但高温下,铁与水蒸气能反应生成一种常见铁的氧化物和一种气体。小明很好奇,设计如下实验探究铁粉与水蒸气反应后的产物。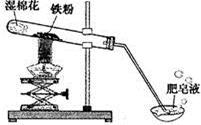
(1)试管尾部放一团湿棉花的目的是 。
(2)探究生成的气体是什么?
反应中有肥皂泡飘到空中时,用燃着的木条靠近肥皂泡,有听到爆鸣声。说明生成的气体是 。
(3)探究试管中剩余固体成分是什么?
【查阅资料】
| 常见铁的氧化物 |
FeO |
Fe2O3 |
Fe3O4 |
| 颜色、状态 |
黑色粉末 |
红棕色粉末 |
黑色晶体 |
| 能否被磁铁吸引 |
否 |
否 |
能 |
【初步验证】试管中剩余固体为黑色,能全部被磁铁吸引。
【猜想与假设】猜想一:剩余固体是Fe与Fe3O4;猜想二:剩余固体是_____________。
【实验探究】根据猜想与假设,设计实验方案加以检验。
| 实验操作 |
实验现象及结论 |
| |
|
【实验结论】 。
【反思与交流】该黑色固体不可能是Fe2O3,理由是 。
在化学实验技能考试中,有一题目是鉴别碳酸钠溶液和氢氧化钠溶液,小红等几位同学进行了如下图所示的实验。
(1)写出试管②中碳酸钠与氢氧化钙反应的化学方程式: 。
(2)实验结束后,小红同学将①、②两支试管中的废液倒入同一个干净的烧杯中,看到废液浑浊,就对废液进行了过滤,小红等几位同学对滤液的成分又进行了探究。
【提出问题】滤液中除水外还含有哪些物质?
【猜想】小红认为:只含氢氧化钠;
小亮认为:可能含有氢氧化钠和碳酸钠;小明认为:可能含有氢氧化钠、碳酸钠和氢氧化钙;
你认为还可能是 (写一种猜想)。
【讨论】你认为小红、小明、小亮三位同学中 的猜想不合理。
【实验设计】设计一个简单的实验证明你的猜想正确。 【反思拓展】
【反思拓展】
①在分析化学反应后所得物质的成分时,除考虑生成物外还需考虑 。
②通过以上探究,你认为应怎样处理上述实验后的废液才能倒入下水道 。
(一)小明和小亮同学在实验室帮老师配制石灰水时,将两药匙熟石灰样品放入小烧杯中,向其中加入一定量的蒸馏水,充分搅拌后发现烧杯底部仍有不溶性的固体,于是小明认为熟石灰样品已经变质。小亮同学不同意他的判断,你认为小亮同学的理由 。同学们针对该熟石灰样品的成分展开了讨论,请你参与讨论并完成实验报告。
【提出问题】熟石灰样品的主要成分是什么?
【作出猜想】甲同学猜想是Ca(OH)2;
乙同学猜想是CaCO3
你认为是 。
【实验与结论】请你通过实验验证你的猜想:
| 实验步骤 |
实验现象 |
实验结论 |
| 取少量的熟石灰样品于烧杯中,加适量的水充分溶解后过滤。 向滤液中加入适量的 溶液; |
; |
乙的猜想不正确 |
| 向滤出固体中加入适量 溶液。 |
。 |
你的猜想正确 |
【拓展与应用】小组同学反思了熟石灰变质的原因,认识到实验室应 保存熟石灰。
(二)在做盐跟盐反应的分组实验时,第一组学生进行BaCl2与Na2CO3溶液的反应,第二组学生进行BaCl2与Na2SO4溶液的反应。实验结束后,两组同学将全部的浊液集中倒进一个废液缸中。浊液中白色沉淀物质是
和 。(填物质的化学式)
化学兴趣小组对浊液进行过滤,探究滤液的成分。
【提出问题】滤液里除了NaCl外,还有什么物质?
【提出猜想】猜想①: ;
猜想②:Na2SO4;
猜想③:Na2CO3;
猜想④:Na2CO3、Na2SO4
【实验探究】
若现象a只有气泡产生,则猜想 可能成立;若现象b产生白色沉淀,然后加稀硝酸沉淀部分溶解,若沉淀全部不溶解,则猜想 成立。
化学小组的同学对金属的性质进行研究。
(1)小明同学通过观察打磨后的镁、锌、铁、铜四种金属,总结出金属共有的物理特征是_______。
(2)小莉将纯铜片和黄铜片相互刻画(如下图1所示),纯铜片上留下明显的划痕,说明_______。
(3)用上图2所示装置进行实验。
①小刚得出结论,镁条反应放出的热量高,它依据的现象是_______。
②观察到试管1中产生气泡的速率比2中快,小明据此得出的结论是_______,欲得此结论设计该实验时应注意_______。
实验室中的试剂一般要密封保存,否则可能会与空气接触而变质。某研究性学习小组发现一瓶未密闭的NaOH固体,对其成分提出以下假设,并完成了实验探究。
假设1:只含NaOH;
假设2:含NaOH和Na2CO3;
假设3:只含Na2CO3
(1)成分中可能含有Na2CO3的原因是(用化学方程式回答) 。
(2)取少量样品于试管中,加入足量稀盐酸,观察到________________,说明假设2或假设3成立。
(3)进一步探究的过程如下:
①“操作1”的名称是 ,
②“固体A”的化学式是___________。
③加入足量CaCl2溶液的作用是 。
④溶液B中滴加酚酞后,观察到 ,说明假设2成立。
试题篮
()