氯气(Cl2)是黄绿色气体,溶于水时部分以Cl2分子存在于溶液中,部分与水反应Cl2 + H2O =" HCl" + HClO。产物中,次氯酸(HClO)是一种弱酸。氯气溶于水所得溶液称为氯水,它具有很强的漂白性。把品红试纸(染有品红颜料的滤纸)放入氯水中,品红试纸褪色。晓红同学对“氯水使品红试纸褪色”产生浓厚兴趣,她所在的学习小组进行了如下探究,请你一起来完成:
【提出问题】氯水中的什么成分使品红试纸褪色?
【猜想】猜想1:氯水中的水使品红试纸褪色;
猜想2:氯水中的Cl2使品红试纸褪色;
猜想3:氯水中的盐酸使品红试纸褪色;
猜想4:氯水中的__________使品红试纸褪色。
【实验探究】
| 实验操作 |
实验现象 |
结论 |
| ①把品红试纸放入水中 |
|
猜想1不成立 |
| ② |
试纸不褪色 |
猜想2不成立 |
| ③ |
试纸不褪色 |
猜想3不成立 |
【结论】学习小组通过讨论,找到了氯水中使品红试纸褪色的物质。
【反思】向氯水中滴加几滴紫色石蕊试液,会观察到的现象是 。
【拓展】铁能在氯气中燃烧生成氯化铁,请写出该反应的化学方程式 。
(6分)某化学实验小组实验结束时,将含有CuSO4、ZnSO4、FeSO4的废液倒在废液缸里,为回收有关金属和盐,同学们设计了如下实验方案: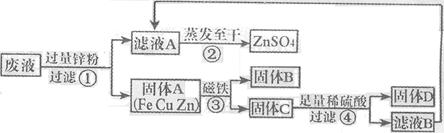
试回答:
(1)步骤①中锌粉必须过量的原因是 。
(2)写出步骤①中任一反应的化学方程式 。
(3)要检验步骤④中加入的稀硫酸是否足量的方法是
。
(4)若实验过程中的物质损失可以忽略,最终所得硫酸锌的质量 (填“>”、“<”或“=”)原废液中硫酸锌的质量。要计算该废液中硫酸铜质量,必须要称量 的质量。
以食盐为原料进行生产并综合利用的某些过程如下图所示。
(1)除去粗盐中的Ca2+、Mg2+和SO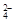 离子,加入下列沉淀剂的顺序是(填序号) 。
离子,加入下列沉淀剂的顺序是(填序号) 。
a.Na2CO3 b.NaOH c.BaCl2
(2)将滤液的pH调至酸性除去的离子是 。
(3)若向分离出NaHCO3晶体后的母液中加入过量生石灰,则可获得一种可以循环使用的物质,其化学式是 。
(4)纯碱在生产生活中有广泛的应用。
① 纯碱可用于除灶台油污。其原因是 。
②工业上,可以用纯碱代替烧碱生产某些化工产品。如用饱和纯碱溶液与Cl2反应制取有效成分为NaClO(次氯酸钠)的消毒液,其反应的化学方程式是 。(已知碳酸的酸性强于次氯酸HClO)。
某学校兴趣小组对食用纯碱和食用小苏打两种粉末进行以下探究。
【查阅资料】两者的热稳定性:
(1)食用纯碱受热不分解。
(2)食用小苏打270 ℃时完全分解为碳酸钠、二氧化碳、水
【实验探究】
(1)验证两种粉末的稳定性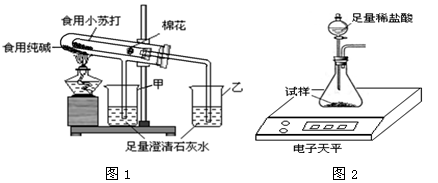
在老师的指导下,该小组按图1所示装置进行实验操作,观察到 (填“甲”或“乙”)烧杯中澄清石灰水变浑浊,小试管中发生反应的化学方程式为 __________ ,装置中棉花的作用是 。写出食用小苏打的一点用途_______________________。
(2)测定食用纯碱粉末的纯度
取食用纯碱粉末试样(假设只含少量氯化钠)22g放入烧杯中,向烧杯中加入200g足量的稀盐酸,充分反应后气体全部逸出,烧杯中剩余物的总质量为213.2g。
①反应生成CO2的质量为 g。
②通过计算确定食用纯碱粉末中Na2CO3的质量分数 (结果保留一位小数,下同)。
③如果测得的结果比实际纯度高,可能的原因是 (答一种即可)。
④求反应后所得溶液中溶质的质量分数(请写出计算过程)。
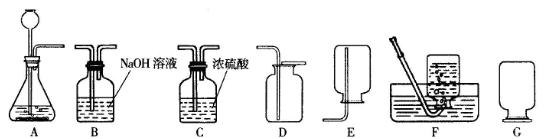
有下图装置,请回答有关问题:
(1)图中标有字母的仪器的名称:m ,n 。
(2)实验室用氯酸钾和二氧化锰共热制取氧气,应选用的发生装置是 (填字母序号),反应的文字表达式为 。
(3)实验室用过氧化氢溶液和二氧化锰制取氧气,若选用C做发生装置,与B相比优点是 。
(4)若用装置E收集氧气,则气体从 (填“a”或“b”)端通入;若使用装置F收集氧气,则气体应
从 (填“c”或“d”)端通入。
(5)小明对妈妈杀鱼时从鱼肚内取出的鱼鳔(如图所示)产生了兴趣,他以“探究鱼鳔内气体体积和成分”作为研究性学习的课题进行探究实验,通过查阅资料获知:这种鱼鳔内氧气约占1/4,其余主要为二氧化碳和氮气,且二氧化碳能溶于水。以下是小明分两步进行的探究实验: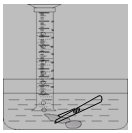
①用两种方法测量鱼鳔内气体体积:A、用医用注射器抽取鱼鳔内气体,测量其体积;B、在水下刺破鱼鳔,用排水集气法收集鱼鳔内气体并测量其体积(如图所示)。你认为测量结果最不准确的一种方法是 (填“A”或“B”),理由是 。
②探究鱼鳔内气体的成分:用两瓶鱼鳔内的气体进行实验,帮助他完成下表中的实验记录:
| 实验目的 |
实验方法 |
实验现象 |
| 验证鱼鳔内含O2 |
|
|
| 验证鱼鳔内含CO2 |
|
|
某化学兴趣小组的同学参照教科书内容,在学校实验室里完成了以下两个实验:
实验一:配制溶质质量分数为6%的NaCl溶液50 g,按如下步骤进行操作:
实验二:称取5.0 g粗盐进行提纯。粗盐除含有NaCl外,还含有MgCl2、CaCl2以及泥沙等杂质。为了有效将粗盐提纯,实验的各步操作流程如下图所示:
请你根据以上信息回答下述问题:
(1)配制50 g溶质质量分数为6%的NaCl溶液,需NaCl______g,水______mL。
(2)NaCl溶解过程中用到了玻璃棒,它的作用是________________。
(3)粗盐提纯时,操作Ⅰ的名称为__________________。
(4)某同学所得精盐比其他同学明显要少,原因可能是____________________。
A.溶解时将5.0 g粗盐一次全部倒入水中,立即过滤
B.蒸发时有一些液体、固体溅出
C.提纯后所得精盐尚未完全干燥
(1)氢气是最轻的气体,难溶于水。氢气作为未来的理想能源,是航天工业的高能燃料,也是化工生产的重要原料。实验室通常采用下面装置制取少量氢气,请根据
要求回答:
要求回答:
①实验室使用稀盐酸和金属锌制取氢气的化学反应方程式为,这种方法制得的氢气往往含有少量(原因是)和水蒸气,可将杂质气体通过装置除去;
②实验中可采用装置收集氢气;集满氢气后的集气瓶按装置G方式放置备用,原因是。
(2)某校课题研究小组到电镀厂考察,了解到铁件镀铜的主要工艺流程如下:

(2)某校课题研究小组到电镀厂考察,了解到铁件镀铜的主要工艺流程如下:
结合流程中提供的信息回答:
①流程Ⅱ废水中含有的物质有;
②经测定:流程Ⅳ中废水的pH为4,废水中一定没有;
③流程Ⅳ废水中除流程Ⅰ、Ⅱ引入的物质外,还含有;
请设计简单方案来证明你的推断:
。
小林的妈妈把家庭久置不用的食盐、纯碱、漂白粉(主要成分是氯化钙和碳酸钙)和生石灰干燥剂中的一种或几种打包准备扔掉。小林为研究白色粉末的组成,将其带到实验室,设计并进行了以下实验:
(1)将部分粉末放人烧杯中,加适量水充分搅拌后,得到白色浊液,杯壁温度无明显变他得出:粉末中一定含有,一定没有,可能含有;
(2)向实验(1)的浊液中滴加酚酞试剂,浊液变红。查阅资料知食盐、氯化钙溶液呈中性他又得出粉末中一定含有。
经反思,小林感觉实验设计还不完善,不能确定粉末中是否含有食盐。
为维护食品安全,卫生部公告自2011年5月1日起,禁止在面粉生产中添加增白剂及过氧化钙等.
(1)过氧化钙的化学式为CaO2,其中氧元素与钙元素的质量比为 .
(2)正确看待和安全使用食品添加剂非常重要.下图是超市售卖的2种不同品牌橙汁的标签.
①2种橙汁均属于 (填“纯净物”和“混合物”).
②你更倾向于选择的品牌是: (填“A”或“B”)为防范添加剂危害,选购包装食品时应 (至少一条).
(5)(3分)过氧化钙在养鱼时可用作增氧剂,多少克过氧化钙(CaO2)和49克氯酸钾(KClO3)中含氧元素的质量相等?(写出计算过程)
小明探究"不同物质的吸热能力"时,在两支相同的试管中分别装入质量相等、温度相同的水和煤油,用一个酒精灯同时对两支试管加热,加热一段时间后,温度计示数如图11所示。
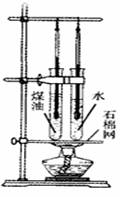
图11
(1)指出图中使用酒精灯的错误:。
(2)水和煤油比较,吸热能力强。
(3)加热一段时间后,煤油的温度升高了4 ℃,则水的温度升高了℃。
[
,
]
(9分)21世纪是海洋开发与利用的世纪。烟台的“十二五”规划确立了“蓝色经济”发展战略,海洋化学资源的综合利用将是重点发展领域之一。
(1)海水淡化:蒸馏法淡化海水是利用海水中各成份的 不同分离出淡水;高压反渗透膜法淡化海水是利用海水中各成份的 不同分离出淡水。
(2)制盐:①制粗盐。从卤水中提取粗盐用的结晶方法是 。②粗盐纯化。粗盐中含有泥沙、硫酸镁、氯化钙等杂质。将粗盐溶于水,然后通过如下操作即可得到较纯的氯化钠:a过滤.b加过量的Ba(OH)2溶液;c加适量的盐酸;d加过量的Na2CO3溶液;e蒸发。正确的操作顺序是 (填字母)。
(3)制碱:氨碱法制纯碱的流程图如下:
完成图中“( )”的内容:① ;② ;③ 。
(4)制镁:工业上一般用电解熔融状态的氯化镁制金属镁,若以卤水(含有硫酸镁、氯化钠和氯化钙)为起始原料来制取金属镁,请画出制镁的流程图。
试题篮
()