"84消毒液"是一种常用含氯消毒用品,有效成分是次氯酸钠(NaClO)。使用时,可根据实际需求进行配比,并规范使用,以防引发危险。
(1)"84消毒液"中的有效氯来自次氯酸钠,计算次氯酸钠中氯元素的质量分数。(计算结果精确到0.1%)
(2)现需要5L有效氯浓度为500mg/L的稀溶液,选用有效氯浓度为50000mg/L的某品牌"84消毒液"进行配制,需加水多少升?( 忽略混合前后溶液体积的变化)
(3)"84消毒液"不能与洁厕灵混合使用,因为"84消毒液"里的次氯酸钠与洁厕灵里的盐酸会发生化学反应,产生的氯气对人体有害,不同浓度氯气对人体的影响如表所示。
| 浓度(mg/m 3) |
对人体的影响 |
| 3000 |
可立即麻痹呼吸中枢,导致瞬间死亡 |
| 120﹣170 |
极为危险,会引起急性肺水肿及肺炎 |
| 40﹣60 |
在1小时内便可致人严重中毒 |
通过计算分析,在10米 3密闭空间里,若将1.49克次氯酸钠与盐酸完全反应,产生的氯气会对人体造成怎样的影响?(次氯酸钠与盐酸反应的化学方程式为:NaClO+2HCl═NaCl+Cl 2↑+H 2O)
“二氧化碳的实验室制取与性质”实验活动产生的废液中含稀盐酸,需先测定其溶质质量分数后进行处理。(杂质不参加反应)
(1)实验时需配制50g 5%的氢氧化钠溶液,若用氢氧化钠固体和水来配制。则需称量氢氧化钠固体的质量为 g。
(2)取20g废液样品于烧杯中,向其中逐滴加入5%的氢氧化钠溶液,恰好完全反应时共消耗氢氧化钠溶液16g。计算废液中盐酸的溶质质量分数。(写出计算过程)
(3)恰好完全反应时烧杯中的溶液所含粒子数目关系:Na+ Cl﹣. (填“>”、“=”或“<”)。
某工厂利用废铁屑与废硫酸反应制取绿矾(FeSO4•7H2O)。
(1)绿矾中铁原子与氧原子个数比为 。
(2)现有废硫酸4.9t(硫酸的质量分数为20%)与足量的废铁屑反应,理论上可生产出绿矾的质量是多少?(请写出计算过程,结果保留三位有效数字,下同)
(3)若配制100g质量分数为20%的稀硫酸溶液,需质量分数为98%的浓硫酸的体积是多少?(已知:质量分数为98%的浓硫酸的密度为1.84g/cm3)。
溶液对动植物的生理活动和人类的生产,科研活动具有重要意义
(1)室温下,某实验小组欲配制200g溶质质量分数为10%的碳酸钠溶液,按如图所示步骤操作。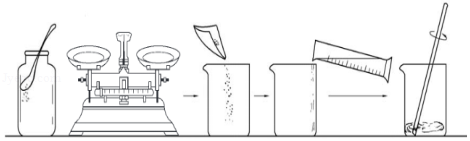
请填空:
①计算:需Na2CO3 g,水 mL(室温时,水的密度的为1.0g/mL)。
②称量:调节天平平衡后称量所需的碳酸钠粉末时,发现托盘天平的指针偏左,此时应 (填写序号A、B、C之一)。
A,调节天平平衡螺母 B.增加适量Na2CO3 C.减少适量Na2CO3
③配制溶液:用量筒量取所需的水,倒入盛有Na2CO3的烧杯中,用玻璃棒搅拌。搅拌的目的是 。
这样得到的溶液即是200g溶质质量分数为10%的Na2CO3溶液。
(2)室温下,实验小组的同学把上述配制的Na2CO3溶液,逐滴加入到盛有100g CaCl2不饱和溶液的烧杯中,生成沉淀的质量与加入Na2CO3溶液的质量关系如图所示。请根据题意回答下列问题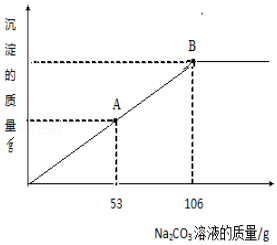
①当滴入Na2CO3溶液53g时(即图中A点),烧杯中溶液里含有的溶质的为 (写化学式)。
②当滴入10%的Na2CO3溶液106g时(即图中B点),恰好完全反应,试通过计算,求此时烧杯中所得不饱和溶液的质量。
(1)化合物可以分为酸、碱、盐及氧化物。在下图中填写不同类别的物质(填化学式)实现Ca(OH) 2一步转化为CaCO 3。
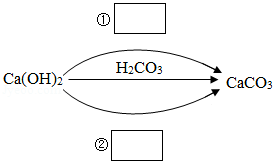
(2)某Ca(OH) 2样品部分变质为CaCO 3(假设其成分均匀)。化学兴趣小组按以下步骤测定该样品中Ca(OH) 2的质量分数。
①配制盐酸:配制500g质量分数为6%的盐酸,需要质量分数为30%的盐酸 g。
②实验测定:
称取10.0g样品置于烧杯中,加入足量稀盐酸充分反应,烧杯总质量与反应时间的关系如下表所示:
| 反应时间/min |
0 |
t 1 |
t 2 |
t 3 |
| 烧杯总质量/g |
280.0 |
278.9 |
277.8 |
277.8 |
完全反应后,生成的CO 2气体的质量为 g。
③数据处理:计算该样品中Ca(OH) 2的质量分数(根据化学方程式的计算写出完整的计算步骤)。
实验室常会产生含硫酸的废水,需经处理至中性。某兴趣小组同学配制一定质量分数的氢氧化钾溶液来处理酸性废水。
(l)定性检测废水
检测废水呈酸性的方法是 。
(2)配制200g质量分数为5.6%的氢氧化钾溶液
①计算
m (KOH)= g,V(H 2O)= mL(水的密度近似为1.0g•mL ﹣ 1)。
②称取氢氧化钾
调节托盘天平平衡后,将一只烧杯放在托盘天平的左盘,称量其质量。然后 (按操作先后顺序,填字母),直至天平平衡。
A.向烧杯中加氢氧化钾固体 B.按需要添加砝码、移动游码 C.量取水 D.溶解 E.转移。
(3)定量测定废水
取酸性废水样品100g,逐滴加入5.6%的氢氧化钾溶液,废水中硫酸的质量分数变化如图所示。(假设废水中其他成分不与氢氧化钾反应且不含硫酸钾)
①P点对应溶液中一定存在的阳离子有 (填离子符号)。
②酸性废水中硫酸的质量分数为 (用百分数表示,保留到0.1%)。
③计算当废水处理至中性时,溶液中硫酸钾的质量分数(写出计算过程,结果用百分数表示,保留到0.l%)。

试题篮
()