下图是某同学完成《实验活动5 一定质量分数的氯化钠溶液的配制》中“配制
50 g质量分数为6%的氯化钠溶液”的全过程。
(1)图中的错误有:
① ;
② 。
(2)若所配制的盐水中NaCl 的质量分数小于6%,则可能造成误差的原因有(至少举
出两点)。
① ;
② 。
(3)由浓溶液配制稀溶液时,计算的依据是 。要把50 g质量分数为98%的浓硫酸稀释为质量分数为20%的硫酸,需要水的质量是 。在实验室用浓硫酸配制稀硫酸的主要步骤有:计算、 、混匀、冷却至室温装瓶并贴上标签。
(4)取某稀硫酸样品10g,将5%的NaOH溶液逐滴加入到样品中,边加边搅拌。溶液pH的变化如图所示。试回答:
①a点溶液中含有的离子有 。
②当pH=7时,消耗NaOH溶液中NaOH的质量为 g。
③计算稀硫酸的溶质质量分数。(写出计算过程)
几位同学在实验室做木炭还原氧化铜的实验,实验完毕后,他们发现试管内仍有黑色固体物质存在。该试管中的黑色固体物质是什么?
【提出猜想】
小玉同学:木炭。 小兰同学:氧化铜。 小华同学: 。
【查阅资料】
(5)木炭、铜都不与稀硫酸反应;Na2O、MgO、CuO、Fe2O3等金属氧化物能与稀硫酸反应生成盐和水。如:MgO+H2SO4==MgSO4+H2O。
(6)硫酸铜溶液呈蓝色
【实验设计】
方案一:向盛有黑色固体的试管中加入足量的稀硫酸,充分振荡,静置后观察现象。
方案二:取少量该黑色固体在空气中灼烧,观察现象。
他们对“方案一”进行了分析讨论,达成了共识:若试管内溶液无色、还有黑色固体存在,证明 同学的猜想正确。若试管中溶液呈蓝色、无黑色固体,证明 同学的猜想正确。若出现的现象是 ,证明小华同学的猜想是正确的,发生反应的化学方程式为 。
他们按照“方案二”进行了实验操作,记录如下:
| 实验现象 |
实验结论 |
| 黑色固体红热并逐渐减少,最后消失 |
该黑色固体是 。 反应的化学方程式是 |
6分)下图是配制溶质质量分数为10%的NaCl溶液的实验操作示意图:
用上图表示的序号表示配制溶液的正确顺序_____ ____。
图②中,有一种塑料仪器,其名称是___ ______。
称量NaCl时,天平平衡后的状态如图⑤所示,游码标尺示数见右图,则称取的NaCl质量为 。
根据计算需要量取水的体积是 (水的密度为1g/mL)。量取读数时,右图视线角度正确的是_______。(选填字母标号)
称量NaCl质量完毕放回砝码时,发现有一个砝码缺损了一个小角,若其他操作步骤正确,则所配溶液的溶质质量分数 (填“大于”、“小于”或“等于”)10%。
氧化钠是生活必需品,也是重要的化工原料。提纯含少量泥沙的粗盐,一般经过下操作流程: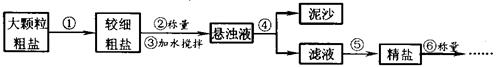
(1)操作①中必须用到的一种仪器是 ▲ (填序号)。
A.研钵 B.量筒
C.烧杯 D.试管
(2)操作④中需要将圆形滤纸折叠处理,下列图示中不该出现的情形是 ▲ (填序号)。
A. B. C. D.
(3)操作⑤中除用到三脚架、酒精灯、玻璃棒、坩埚钳外,还需要用到 ▲ 等仪器。该操作中容易造成食盐固体飞溅,为尽量减少飞溅,除连锁搅拌外还可采取 ▲ 等措施。
(4)实验结束后称量获得的精盐,并计算精盐的制得率,发现制得率较低,其可能原因是 ▲ (填序号)。
A.食盐没有全部溶解即过滤
B.蒸发时食盐飞溅剧烈
C.蒸发后,所得精盐很潮湿
D.器皿上沾有的精盐没全部转移到称量纸上
甲、乙两位同学分别用如图所示装置进行实验。
(1)甲同学验证燃烧的条件。取一小块白磷放入广口瓶中,一段时间白磷没有燃烧,然后从分液漏斗中加入适量的________,白磷仍然没有燃烧,再从a管通入________,白磷发生燃烧,该实验________(填“能”或“不能”)证明可燃物燃烧需要与氧气接触、温度达到着火点这两个条件。
(2)乙同学验证二氧化碳与水的反应。为验证使石蕊变色的物质是碳酸而不是水或二氧化碳,应该采取的实验操作顺序是________(填序号,可重复选用)。
① 从b端通氮气 ② 从分液漏斗中滴加适量水
③ 从a端通二氧化碳 ④ 将石蕊溶液染成紫色的干燥纸花放入广口瓶中
(1)实验室给你提供了下列仪器,请选用合适的仪器完成指定的实验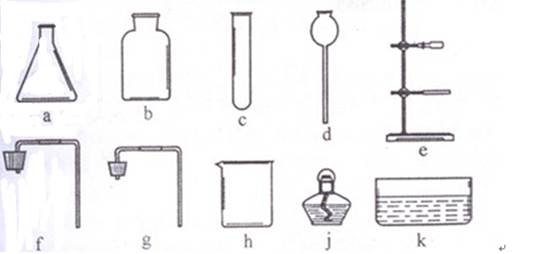
①要制取较多的O2用来探究其性质(要求制取过程中可以添加反应物),组装气体发生装置需要的仪器是 (填序号),收集氧气应采用 法。
②提纯初盐时,过滤需要选用上述仪器中的 (填序号),出此之外还缺少的仪器是滤纸、 、 (填名称)。
(2)美羊羊同学的购物袋装薯片中发现还有一个小袋,上面标有“成分:CaO、Fe;作用:防潮、防氧化;警告:禁止食用”等字样,撕开小袋,发现里面的固体粉末有少许是棕红色,大多数是灰白色的。经过分析,她认为棕红色粉末是Fe2O3,灰白色粉末应该含有CaCO3和Fe,为验证自己的判断,美羊羊同学打算进行实验探究,请你一同参与。
【实验目的】证实灰白色粉末中含有CaCO3和Fe。
【实验设计】装置如下图所示:
【实验预测与分析】
①要证实样品中含有CaCO3,观察到的实验现象是 ,B中发生反应的化学方程式为 。
②若要证实样品中含有Fe,E中应该观察到的现象是 ,此时C装置的作用是
③看了美羊羊同学的分析结论,有同学认为小袋内灰白色粉末中还应该有别的物质,请你写出其中一种物质的化学式 。
实验室常利用下列装置制取并探究气体的有关性质,请你根据所学知识回答下列问题:
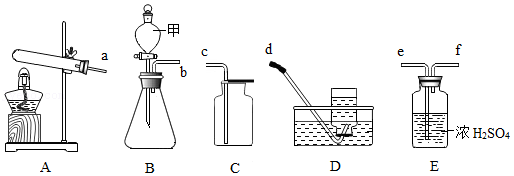
(1)仪器甲的名称是 ;
(2)氧气与世间万物如影随形,动植物呼吸、燃料燃烧、钢铁冶炼等都需要氧气,实验室利用B装置制取氧气时所发生反应的化学方程式为 ,若要收集一瓶干燥的氧气,装置接口连接顺序为b→ → → ;
(3)甲烷是一种密度小于空气,难溶于水且具有可燃性的气体,实验室里也可利用上述装置通过加热无水醋酸钠和碱石灰固体混合物的方法来制取,则制取装置为 。某同学将一定量的甲烷气体置于盛有氧气的密闭容器中点燃,反应结束后测得容器中CO和CO2的总质量为37.6g,同时测得水的质量为36g,请根据数据写出该反应的化学方程式 。
该同学对甲烷的其它化学性质产生了兴趣:
【提出问题】甲烷除了可燃性外,还具有什么化学性质?
【查阅资料】无水硫酸铜遇水变成蓝色
【作出假设】甲烷具有还原性
【设计并进行实验】该同学按如图装置进行实验:

【实验现象与结论】
通入甲烷加热一段时间后才观察到A装置中黑色固体变为红色,B装置中无水硫酸铜变为蓝色,C装置中氢氧化钙溶液变浑浊。根据现象写出甲烷与氧化铜发生反应的化学方程式 。通过实验证明,甲烷具有还原性。
【反思与评价】
实验时,先向装置中通入一段时间的氮气,再通入甲烷加热的目的是 。
实验室用高锰酸钾制取氧气,请结合下列装置,回答问题:
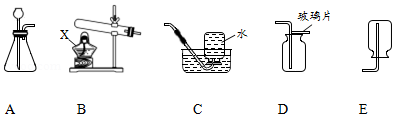
(1)写出仪器X的名称: ;
(2)要制备较为纯净的氧气,应选用的发生装置和收集装置是 (填序号),该反应的化学方程式为 ;
(3)该实验的主要步骤有:①将导气管移出水槽;②加热;③装药品、棉花;④收集;⑤熄灭酒精灯;⑥检查装置气密性。正确的操作顺序为 。
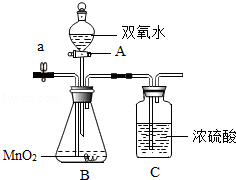
实验室新购买了一批双氧水(H2O2)溶液,某兴趣小组的同学要测定其质量分数,他们设计如图所示的装置,其实验的操作步骤如下:
①组装仪器,并检查装置的气密性;
②在A、B、C三个仪器中装入药品,其中双氧水溶液质量为50g;
③用电子秤称量出整套装置的总质量为498.6g;
④关闭a处止水夹,打开A仪器的阀门,向锥形瓶中加入全部的双氧水溶液,随即关闭A仪器的阀门;
⑤充分反应后,打开a处止水夹,向装置中持续缓慢地鼓入X气体;
⑥第二次称量整套装置的总质量为497g。
(1)本实验采用的装置中,A仪器的名称是
(2)为尽可能减小测量误差,请结合测量原理判断,操作⑤中鼓入的X气体是 。
A.氦气 B.经干燥处理的空气 C.除去氧气后的空气
(3)根据题意,计算双氧水溶液中溶质的质量分数,写出计算过程。
焦亚硫酸钠(Na2S2O5)是一种常用的食品抗氧化剂,小金模仿化工生产,用如图装置来制取Na2S2O5。
已知:A中发生的反应为:H2SO4(浓)+Na2SO3═Na2SO4+SO2↑+H2O
B中发生的反应为:Na2SO3+SO2═Na2S2O5

(1)图中盛放浓硫酸的仪器名称是 ;
(2)写出C中发生反应的化学方程式 ;
(3)在实验过程中,滴加浓硫酸不宜过快,理由是 。
(4)该实验开始滴加浓硫酸时,应先除尽装置内的空气,若忘记这一操作,新制取的Na2S2O5产品中会混有Na2SO4杂质,这与O2的 有关(填化学性质)
下图是实验室中用于制取气体、验证性质的装置图,请回答下列问题:
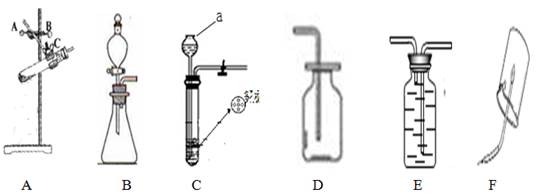
(1)图C仪器a名称
(2)若选用A装置加热氯酸钾和二氧化锰的混合物制取氧气,化学方程式: ,所缺仪器是的名称 ,需调节该装置旋钮 ,使 。
(3)若用D装置收集二氧化碳,验满的方法是 。
(4)先用 E 装置收集氢气,则气体从 进(填“长管”或“短管”),然后验证其性质,如图F,观察到火焰的颜色为 。
(5)某同学用二氧化锰粉末和过氧化氢溶液制取氧气,化学方程式为: 。若用A装置,发现反应过于剧烈,不易控制,此时可以选择 装置获得平稳的氧气流。若用所选装置与装置E连接,加入13.6g一定质量分数的过氧化氢溶液制取氧气,理论上应收集2.2L氧气,而实际收集到氧气的体积约为3.2L,这是因为 。
试题篮
()