根据下列仪器装置,回答问题。

(1)写出仪器名称:①为 ,②为 。
(2)实验室用MnO2和双氧水制取O2,反应的化学方程式为 ;装入药品前必须进行的操作是 ;实验室制取H2可选用装置 (填字母序号)。
(3)实验室用混有MnO2的KClO3固体制取O2,MnO2在反应中起 作用。
(4)实验室可用 (填物质名称)干燥CO2。用装置E进行CO2的部分性质实验:将干燥的紫色石蕊试纸放在 (选填“a”“d”)处,并与b处现象对比,可说明CO2能与水反应;c处发生反应的化学方程式为 。
多种物质都可催化过氧化氢分解,如MnO2、CuSO4等。实验小组的同学探究漂白液(主要成分是NaClO和NaCl)、FeCl3、K2SO4能否催化过氧化氢分解。
(1)MnO2催化过氧化氢分解的化学方程式是 。
(2)如图所示,分别向三支试管中多次加入5%过氧化氢溶液,每次2mL,如有气泡产生,则将① 伸入试管,检验是否有氧气生成。结果如下表。

研究对象 |
第1次 |
第2次 |
第3次 |
第4次 |
漂白液 |
大量气泡 |
较多气泡 |
少量气泡 |
无气泡 |
FeCl3溶液 |
较多气泡 |
较多气泡 |
较多气泡 |
较多气泡 |
K2SO4溶液 |
② |
/ |
/ |
/ |
实验结论 |
ⅰ.实验中产生的气体都是氧气。(查阅得知:NaClO+H2O2═O2↑+NaCl+H2O) ⅱ.K2SO4不能催化过氧化氢分解。 ⅲ.③ 可能是过氧化氢分解的催化剂。 ⅳ.…… |
|||
(3)下列物质中,也可能是过氧化氢分解的催化剂的是 (填标号)。
A.CuCl2
B.Fe2(SO4)3
C.Na2SO4
D.KCl
(4)探究不同催化剂催化效果的实验方案:将等体积5%过氧化氢溶液加到不同催化剂中,比较用排水法收集50mL氧气的快慢。请从如图中选择合适的仪器(每种仪器限用一次),组成该探究的完整实验装置,不需要用到的是 。(填标号)。

下列图象表示的化学反应过程,与实际情况相符合的是( )
(说明:①至④对应的每组实验其他条件均相同)
| A. |
|
| B. |
|
| C. |
|
| D. |
|
下列图象与对应的叙述相符合的是( )
| A. |
|
| B. |
|
| C. |
|
| D. |
|
下列图象与对应的操作过程相符的是( )
A. 向一定量的氯化钙溶液中通入二氧化碳至过量
向一定量的氯化钙溶液中通入二氧化碳至过量
B.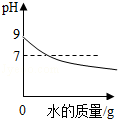 向pH=9的氨水中不断加水稀释
向pH=9的氨水中不断加水稀释
C.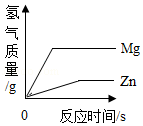 将等质量的镁片和锌片分别加入足量且溶质的质量分数相同的稀硫酸中
将等质量的镁片和锌片分别加入足量且溶质的质量分数相同的稀硫酸中
D. 用两份溶液质量和溶质的质量分数均相等的过氧化氢溶液制取氧气
用两份溶液质量和溶质的质量分数均相等的过氧化氢溶液制取氧气
过氧化氢能极缓慢分解,可看成分解为水和氧原子:H2O2→H2O+O,其水溶液显弱酸性。过氧化氢是实验室中重要化学试剂,在生产生活中有重要用途。回答下列问题:
(1)过氧化氢中氧元素的化合价为 。
(2)MnO2能加快过氧化氢分解,氧原子再结合成氧分子而制得氧气,MnO2在反应中作 剂,下列装置可用于制取氧气的是 (选填字母编号,下同),可用于收集氧气的装置有 。
(3)氧原子容易与许多有机物反应而破坏其结构,所以过氧化氢溶液能杀死新冠病毒,这个过程叫做蛋白质的 。
(4)向氢氧化钠溶液中滴加酚酞试液,再滴加过氧化氢溶液,观察到溶液先变红后褪色,猜想其褪色原因可能有两种:
①H2O2显酸性消耗了NaOH,而使红色褪去;
②H2O2分解产生的氧原子与酚酞反应破坏其结构,而使红色褪去。究竟哪种猜想合理?请用本次实验用过的试剂设计实验 (补充完实验方案)。有兴趣的同学可在后续学习中通过实验得出结论。
如图是一款变色眼镜,它的镜片内含有溴化银和氧化铜。在强光照射下,溴化银分解成单质溴和银,镜片颜色变深;当光线变暗时,溴和银在氧化铜催化作用下,又立即化合成溴化银,镜片颜色变浅。有关该眼镜的说法错误的是( )

A.塑料是高分子合成材料
B.铜螺丝久置在潮湿的空气中会产生铜锈
C.溴化银分解后,银元素的化合价升高
D.溴和银化合成溴化银前后,氧化铜化学性质不变
下列说法正确的是( )
A.由同种元素组成的物质都是单质
B.铁制品表面的铁锈能阻碍里层的铁继续锈蚀
C.浓硫酸有吸水性,在实验室中常用作某些气体的干燥剂
D.催化剂在化学反应前后,其质量和化学性质都不发生变化
下列有关催化剂的说法正确的是( )
A.在化学反应后其质量减小
B.催化剂只能加快化学反应速率
C.在化学反应后其化学性质不变
D.过氧化氢分解反应中,只能用二氧化锰作催化剂
推理是学习化学的重要方法,下列推理正确的是( )
A.有机物都含有碳元素,则含碳元素的物质一定是有机物
B.单质由同种元素组成,则由同种元素组成的纯净物一定是单质
C.中和反应有盐和水生成,则有盐和水生成的反应一定是中和反应
D.催化剂在化学反应前后质量不变,则化学反应前后质量不变的物质一定是催化剂
下列有关催化剂的说法正确的是( )
A.在化学反应后其质量减小
B.在化学反应前后其化学性质发生了变化
C.在化学反应后其质量增加
D.催化剂能改变化学反应速率
空气质量意味着生活质量。
(1)下表为某同学测量的呼吸前后气体组成的实验数据(通常状况)。
物质 |
吸入空气(体积分数/%) |
呼出气体(体积分数/%) |
氮气 |
78 |
75 |
氧气 |
21 |
16 |
二氧化碳 |
0.03 |
4 |
水蒸气 |
a |
b |
①氮气的化学性质比较 (填“稳定”或“活泼”),在呼吸前后没有发生变化,实验中呼出气体的总体积 吸入空气的总体积(填“>”“=”或“<”)。
②呼吸时消耗O2产生CO2,该过程 能量(填“吸收”或“释放”)。呼吸前后气体中水蒸气含量变化较大,实验中其体积分数b a(填“>”“=”或“<”)。
(2)汽车多以汽油为燃料,辛烷(C8H18)是汽油中的一种成分。
①每114g C8H18完全燃烧,需要消耗400g O2,生成mg CO2和162g H2O,则m= g。
②与完全燃烧相比,等质量的C8H18不完全燃烧时会产生CO,消耗O2的质量 (填“偏大”“相等”或“偏小”),除污染环境外,燃料不完全燃烧还会产生的问题是 浪费 (写出一种)。
(3)“远在高空是地球卫士,近在身边是健康杀手。”臭氧(O3)对环境的作用需辩证地认识。
①高空中臭氧层能吸收紫外线。有学者认为,致冷剂氟利昂进入高空大气后会产生氯原子(Cl•),引发以下反应:Cl•+O3═ClO•+O2 Ⅰ
2ClO•═2Cl•+O2 Ⅱ
Cl•加快了上述转化过程总反应的速率,但自身的质量和化学性质在总反应前后没有发生变化,其作用是 ,该转化过程总反应的化学方程式为 。
②地面附近的臭氧是一种空气污染物,臭氧属于 (填“单质”或“化合物”),O3可表示一个 (填“原子”“分子”或“离子”)。
(4)有人提出:你吸入的空气中的某个氧原子可能自于若干年前恐龙的身体。该说法表达的观点是 (填字母)。
A.分子聚集形成物质,分子在不停地运动
B.在化学变化中原子既不会产生,也不会消失
C.原子内部结构复杂,原子不是构成物质的最小微粒
化学是一门以实验为基础的科学。

(1)仪器a的名称是 。
(2)实验室用高锰酸钾制取氧气的化学方程式为 ;选择的装置组合是 (填序号)。
(3)实验室用锌粒和稀硫酸制取氢气的化学方程式为 ;若要控制反应的发生或停止,应选择的发生装置是 (填序号),利用D装置收集氢气的理由是 。
(4)某化学兴趣小组设计如下表所示的对比实验来比较MnO2、CuO对过氧化氢分解的催化效果,所用实验装置如图2所示。
实验序号 |
过氧化氢溶液 |
催化剂 |
实验1 |
5mL 4% |
粉末状MnO20.2g |
实验2 |
5mL 4% |
粉末状CuO 0.2g |

①实验1中制取氧气的化学方程式为 。
②实验需要测量并记录的数据有:氧气体积和 。
③实验时,分别将过氧化氢溶液一次性注入盛有催化剂的小试管中,测量并记录数据,实验过程中发现U型管内右侧液面上升,原因是 。
④结论:MnO2对过氧化氢分解的催化效果比CuO好,得出该结论的依据是 。
有科学家认为“氢能将成为未来主要的能源”,图1是利用太阳能将水转化为氢能的两条理想途径。

(1)途径一“光电转换”过程中,光能转化为 能,可较好解决传统制氢过程中效率低、 等问题。
(2)途径二中反应过程的微观示意图如图2所示。
①请将图2中方框内微粒补充完整 。
②该反应前后催化剂的化学性质和 均不发生改变。
③该反应过程中不发生变化的微粒是 (填化学符号)。
试题篮
()