下列实验操作符合规范要求,能达到目的是( )
A.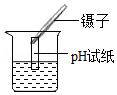 测定溶液的pH
测定溶液的pH
B. 证明MnO2的催化作用
证明MnO2的催化作用
C. 证明CO2已集满
证明CO2已集满
D. 测定空气中O2的含量
测定空气中O2的含量
如图为实验室制取某些气体的装置示意图,据此回答有关问题:

(1)写出图中序号①的仪器名称
(2)实验室用双氧水和二氧化锰制取氧气,反应的化学方程式为 ;其中二氧化锰的作用是 ;若选用E装置收集氧气,气体应从 端(填a或b)进入.
(3)检查A装置气密性的方法为 .
(4)通常状况下,甲烷是一种无色无味气体、难溶于水、密度比空气小.实验室常用醋酸钠和碱石灰两种固体混合加热制得,制取并收集甲烷可选用的装置是 (填字母)
实验室使用过氧化氢溶液与二氧化锰制取氧气并回收二氧化锰,可供选择的实验仪器和用品如图。

(1)制取氧气的化学方程式是 。
(2)制取氧气时,用a仪器加入过氧化氢溶液的优点是 (填序号)
A.便于控制反应快慢 B.定量添加药品更方便 C.生成氧气质量更大
(3)回收二氧化锰,需要进行过滤操作,除如图仪器以外,过滤还需要的仪器名称 。
(4)过滤时, (填序号)的末端要轻轻的斜靠在三层滤纸的一边。过滤结束后,小心取下滤纸,将纸上的固体 (操作名称),转移装瓶,贴上标签。生活中可以替代滤纸的物品是 (填一种)
(5)回收的二氧化锰,还可以在上述反应中反复使用。其原因是 。
H 2O 2分解时可以使用的触媒不止MnO 2一种。为比较相同浓度的FeCl 3溶液和CuSO 4溶液对H 2O 2分解的催化效果,某研究小组进行了如下探究(如图):
(1)写出H 2O 2分解(MnO 2作催化剂)的化学方程式 。
(2)用图甲的实验来进行定性探究,通过观察 可比较两者的催化效果是不同的。 
(3)用图乙的实验来进行定量探究,实验前检查该装置气密性的方法是 。要定量的比较出两者的催化效果,可测量生成等体积气体时所需的 。
(4)在FeCl 3溶液中有一种粒子起催化作用,究竟是哪一种呢?
猜想一:铁离子(Fe 3+)起催化作用; 猜想二: 起催化作用;
猜想三: 起催化作用。
请设计实验,验证猜想一:
| 实验操作 |
实验现象及结论 |
| 分别取同温度同体积同浓度的H 2O 2溶液于2支试管中,再分别加入 和 ,观察现象。 |
|
下列叙述正确的是( )
A.纯净物只含一种元素
B.凡是有氧元素参与的反应就是氧化反应
C.任何饱和溶液升高温度均能变为不饱和溶液
D.催化剂在化学反应前后质量和化学性质都不会改变
下列图象能正确反应对应变化关系的是( )
A. 加热氯酸钾制取氧气
加热氯酸钾制取氧气
B. 向一定稀硫酸中不断加水
向一定稀硫酸中不断加水
C. 等质量的Mg和Al分别与足量的稀盐酸反应
等质量的Mg和Al分别与足量的稀盐酸反应
D. 在CuSO4溶液中加入足量Zn粉后溶液的质量变化
在CuSO4溶液中加入足量Zn粉后溶液的质量变化
实验室要制取氧气和二氧化碳,现有氯酸钾、二氧化锰、石灰石、稀盐酸和稀硫酸,以及下列仪器,回答下列问题。
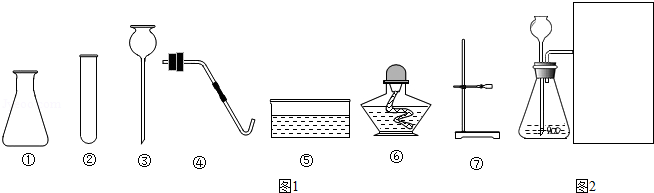
(1)仪器①的名称是
(2)利用上述仪器和药品制取氧气时,发生装置应选择的仪器是有 (填仪器序号),选择的药品中,二氧化锰的作用是 。
(3)制取二氧化碳时,反应的化学方程式是 ,除上述仪器外,另选仪器在如图2内画出排空气收集二氧化碳的装置。
(4)实验室一般不用块状石灰石与稀硫酸反应制取二氧化碳,但能用石灰石粉末与稀硫酸来制取,能制取的理由是 。
下列关于催化剂的说法正确的是( )
A.化学反应前后催化剂的质量不变
B.化学反应前后催化剂的性质不变
C.催化剂只能加快化学反应速率
D.没有催化剂化学反应不能发生
关于催化剂的下列说法中,正确的是( )
| A. |
化学反应后催化剂本身的质量减少 |
| B. |
化学反应后催化剂本身的质量增加 |
| C. |
催化剂可改变化学反应速率 |
| D. |
化学反应后催化剂的化学性质发生变化 |
下列关于催化剂的说法正确的是( )
| A. |
催化剂必定加快反应速率 |
| B. |
反应前后催化剂的化学性质通常会发生改变 |
| C. |
在酿造工业和制药工业,一般都要用酶作催化剂 |
| D. |
用氯酸钾制取氧气时,加入催化剂可使生成氧气的质量增加 |
甲、乙、丙,丁四种物质在反应前后的质量关系如图表示,下列说法正确的是( )

A.丁一定是化合物
B.该反应是化合反应
C.丙一定是该反应的催化剂
D.反应前后甲和乙变化的质量比为9:8
下列说法错误的是( )
A.洗涤剂具有乳化功能,能洗去餐具上的油污
B.武德合金熔点低,可以作保险丝
C.二氧化锰可以作任何反应的催化剂
D.空气中体积分数最大的气体是氮气
下列说法错误的是( )
A.可用肥皂水鉴别硬水、软水
B.铵态氮肥不能和碱性物质混合施用
C.催化剂在化学反应前后的质量和性质不变
D.防止金属锈蚀是保护金属资源的有效方法
实验探究一:课本第二单元课后作业中有"寻找新的催化剂"的探究内容,实验中学探究小组据此设计了如下探究方案.
【提出问题】红砖粉末能否作为过氧化氢溶液分解的催化剂?如果能,效果如何?
【实验探究】
| 实验步骤 |
实验现象 |
实验结论及解释 |
| Ⅰ. |
A中无明显现象,B中产生大量能使带火星木条复燃的气体 |
①产生的气体是 ②红砖粉末能改变过氧化氢分解速率 |
| Ⅱ.向B试管中重新加入5%的过氧化氢溶液,反应停止后过滤、洗涤、干燥、称量滤渣 |
①又产生大量能使带火星木条复燃的气体 ②滤渣质量等于ag |
红砖粉末的 在反应前后均没有发生变化,能作过氧化氢分解的催化剂 |
| Ⅲ. |
两试管中均产生气泡且 |
红砖粉末的催化效果没有二氧化锰粉末好 |
【拓展应用】
已知CuSO 4也可作为过氧化氢分解的催化剂.向101.2g一定溶质质量分数的过氧化氢溶液中加入2g CuSO 4粉末,充分反应后得到溶质质量分数为2%的溶液,则生成氧气 g.
实验探究二:实验室中的试剂一般要密封保存,否则可能会与空气接触而变质.淅河中学化学学习小组发现一瓶未密封的氢氧化钾固体,对其是否变质进行探究.
【提出猜想】1.未变质 2.部分变质 3.完全变质
【查阅资料】KOH与NaOH性质类似,也能与CO 2反应而变质.写出KOH变质的化学方程式为 .
【设计实验】
(l)取少量样品于试管中配成溶液,滴加足量稀盐酸有气泡产生,则猜想 不成立.
(2)准确称取一定质量的固体样品,放在如图所示装置中进行实验,根据CO 2的体积和密度计算变质产物的质量,从而确定变质情况,你认为这个方案是否可行,并说明理由 .
(3)请你另外设计一个方案,进一步探究变质情况
| 实验步骤 |
实验现象 |
实验结论 |
|
|
|
猜想2成立 |

试题篮
()