甲、乙、丙三种物质的溶解度曲线如图1所示。回答下列问题:

(1)当温度为 ℃时,甲、丙两种物质的溶解度相等。
(2)t3℃时,甲物质的饱和溶液中,溶质和溶液的质量比为 。
(3)若采用升温、恒温蒸发溶剂、增加溶质的方法都能使接近饱和的溶液变成饱和溶液,则该物质是 。
(4)R是甲,乙、丙三种物质中的一种,现用R作图2实验,①②中没有固体析出,③中有固体析出。根据图示信息,以下几种说法正确的是 (填标号)。

A.R是甲物质
B.①和②的溶液中,溶质质量相等
C.①②③中,只有③的上层清液是饱和溶液
D.①的溶液中溶质的质量分数比③的上层清液中溶质的质量分数小
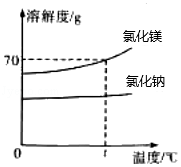
大连复州湾盐场是我国四大海盐场之一,利用传统的海水晒盐工艺,可得到氯化钠和氯化镁等物质。如图是氯化钠和氯化镁的溶解度曲线。
(1)两种物质中, 的溶解度受温度的影响较大。
(2)t℃时,氯化镁饱和溶液中溶质与溶剂的质量比为 。
(3)将接近饱和的氯化钠溶液变为饱和溶液,可采用的一种方法是 。
(4)海水晒盐是利用 的方法获得晶体。
如图是甲、乙、丙三种物质的溶解度曲线。

(1)t 1℃时,三种物质的溶解度由大到小的关系为 。
(2)t 2℃时,甲、乙、丙三种物质的饱和溶液降温至t 1℃时为不饱和溶液的是 。
(3)现有含少量甲的乙固体,若要通过结晶法进行提纯乙(甲与乙不发生反应),现有下列实验步骤可供选择:
①取一定量的水将固体溶解②充分冷却后过滤③趁热过滤④加热蒸发至大部分晶体析出⑤加热蒸发至溶液接近饱和⑥停止加热用余热将溶液蒸干⑦用少量水洗涤晶体并烘干。合理的操作顺序为 (按顺序填编号)。
(4)t 3℃时,取等质量甲、乙、丙三种物质的饱和溶液,恒温蒸发一定质量的水(析出的晶体均不含结晶水),析出晶体的质量关系为甲=乙<丙,则剩余溶液的质量由大到小的关系为 。
(5)t 2℃时,配制甲、乙、丙三种物质的饱和溶液,一定相等的是 (填字母)。
A.溶质质量
B.溶剂质量
C.溶质质量分数
D.溶解度
NaOH、KNO3和Na2CO3在不同温度下的溶解度如下表所示。
温室/℃ 溶解度/g 物质 |
0 |
10 |
20 |
30 |
40 |
NaOH |
42.0 |
51.0 |
109.0 |
119.0 |
129.0 |
KNO3 |
13.3 |
20.9 |
31.6 |
45.8 |
63.9 |
Na2CO3 |
6.0 |
16.0 |
18.0 |
36.5 |
50.0 |
下列实验过程中不考虑化学变化、水的蒸发和结晶水合物等因素。
(1)10℃时,KNO3的溶解度 (填“>”、“<”或“=”)Na2CO3的溶解度。
(2)40℃时,将129g NaOH固体加入到100g水中,搅拌后固体全部消失,放置到t1时刻开始析出固体,到t2时刻析出10g固体。
①t1时刻为 (填“饱和”或“不饱和”)溶液。
②t2时刻溶液的温度为 ℃。
(3)40℃时,将等质量的三种物质的饱和溶液冷却到30℃,所得溶液中溶剂质量最多的是 (填序号)。
A.Na2CO3溶液
B.KNO3溶液
C.NaOH溶液
在一定温度下,向100g水中依次加入一定质量的KCl固体,充分溶解,加入KCl固体的质量与所得溶液质量的关系如图所示:

(1)该温度下,实验①所得溶液是 溶液(填“饱和”或“不饱和”)。
(2)该温度下,KCl的溶解度为 。
(3)实验③所得溶液中溶质的质量分数是 (填选项序号)。
a.40% b.37.5% c.28.6%
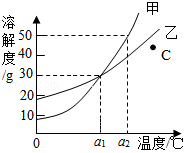
如图为甲、乙两种物质(均不含结晶水)的溶解度曲线。据此回答下列问题:
(1)当温度为 ℃时,甲、乙两种物质的溶解度相等。
(2)图中C点对应的乙溶液是 (填“饱和”或“不饱和”)溶液。
(3)当温度为a2℃时,在100g水中加入60g甲,溶液中溶质的质量分数为 (结果保留三位有效数字)。
已知NH4Cl、KNO3在不同温度时的溶解度
温度/℃ |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
|
溶解度/g |
NH4Cl |
29.4 |
33.3 |
37.2 |
41.4 |
45.8 |
50.4 |
55.2 |
60.2 |
65.6 |
KNO3 |
13.3 |
20.9 |
31.6 |
45.8 |
63.9 |
85.5 |
110 |
138 |
169 |
|
请回答下列问题:
(1)在35℃时,KNO3的溶解度 NH4Cl的溶解度。(填“>”或“=”或“<”)
(2)若KNO3固体中含有少量NH4Cl固体,可采用 获得KNO3晶体。(填“蒸发结晶”或“降温结晶”)
(3)25℃时,将15克KNO3固体溶解在50克水中,所得溶液为 。(填“饱和溶液”或“不饱和溶液”)
(4)20℃时,饱和NH4Cl溶液溶质质量分数为 。(精确到0.1%)
NaHCO3在生产和生活中有许多重要用途,某学习小组对其性质进行了如下探究。物质的溶解度见下表。回答下列问题:
温度 |
10℃ |
20℃ |
NaHCO3的溶解度(g/100g水) |
8.1 |
9.6 |
Ca(HCO3)2的溶解度(g/100g水) |
16.6 |
(1)在20℃时称取4g NaHCO3加入46mL蒸馏水(密度取值为1g/mL),充分搅拌制得澄清溶液。该实验可以达到探究NaHCO3 性的目的;实验中不需要的仪器是 (选填字母编号)。

(2)用pH计测得溶液的pH为8.2,说明溶液呈 性。
(3)所配NaHCO3溶液的质量分数等于 ,降温到10℃时溶液 (填“是”或“不是”)饱和溶液。
(4)取2mL所配NaHCO3溶液于试管中,滴加5%的CaCl2溶液,观察到气泡和白色沉淀,实验证明该气体是CO2.据此小组同学讨论认为:白色沉淀不可能是Ca(OH)2,其理由是 ,于是得出结论:白色沉淀是 。
如图是A、B、C三种固体物质的溶解度曲线。
(1)P点表示的含义是 。
(2)t1℃时,将35gA物质加入到50g水中,形成 (填“饱和”或“不饱和”)溶液。
(3)B中混有少量的A,提纯B的方法是 。
(4)将等质量的A、B、C三种固体物质分别配成t3℃时的饱和溶液,所得溶液的质量最多的是 。
(5)将t1℃时A、B、C三种物质的饱和溶液升温到t3℃时,所得溶液的溶质质量分数由大到小的关系是 。

如图是甲、乙两种固体物质的溶液度曲线。请回答下列问题:
(1)a1℃时甲和乙的饱和溶液,升温到a2℃时 (填“仍是”或“不是”)饱和溶液。
(2)甲和乙的溶解度在 ℃时相等。
(3)a1℃时,将20g乙加入50g水中,所得溶液质量为 g。
(4)a2℃时,在100g水中加入25g甲,所得溶液溶质的质量分数为 。

甲、乙、丙三种物质的溶解度曲线如图所示,回答下列问题:
(1)t1℃时,甲、乙、丙三种物质溶解度由大到小的顺序是 。
(2)t3℃时,将20g物质丙加入50g水中充分溶解,并恢复到原温度,所得溶液的溶质质量分数为 。(结果保留到0.1%)
(3)在不改变溶质质量分数的前提下,将甲的不饱和溶液转化为饱和溶液的方法是 。
(4)下列说法不正确的是 (填字母序号)。
A.t1℃时,用甲、乙、丙三种固体配制等质量的饱和溶液,所需水的质量大小关系是乙>甲>丙
B.t2℃时,甲、丙两物质饱和溶液中所含溶质质量相等
C.将t3℃时的甲、丙的饱和溶液降低温度至t2℃,所得溶液的溶质质量分数相等
D.乙中混有少量甲,可以采用蒸发结晶的方法提纯乙

科学发现往往源于对实验现象的观察与研究。
(1)如图甲进行白糖溶解实验,根据图中现象判断:溶液② (填“是”“不是”或“可能是”)白糖的饱和溶液。

(2)如图乙所示,小科利用集气瓶收集从导管导出的氧气时,每隔一段时间,他就取出导管,再用带火星的木条放在瓶口验满。可是他始终没有观察到带火星木条复燃,小科实验操作中出现的错误是 。
氯化钠具有广泛的用途。

(1)生理盐水中的溶剂是 。
(2)生理盐水标签如图1所示。某同学欲配制标签中所标示的生理盐水一瓶,需要水的质量是 g。
(3)氯化钠主要存在于海水中,海水晒盐能够得到粗盐和卤水。卤水中含有MgCl2、KCl和MgSO4等物质,如图2是它们的溶解度曲线。分别将t2℃的MgCl2、KCl和MgSO4三种物质的饱和溶液降温到t1℃时,溶液中溶质质量分数从大到小的关系是 (填写字母序号)。
(4)某同学利用实验探究NaCl在水中的溶解度,所得数据记录如表。
序号 |
温度 |
水质量 |
加入NaCl质量 |
溶液质量 |
① |
20℃ |
25g |
9g |
34g |
② |
20℃ |
50g |
20g |
68g |
③ |
20℃ |
100g |
34g |
134g |
④ |
20℃ |
150g |
54g |
204g |
上述实验中,所得溶液为饱和溶液的是 (填数字序号)。
t℃时,将一定质量的甲、乙两种溶液进行恒温蒸发,蒸发溶剂的质量与析出晶体的质量之间的关系如图所示。回答下列问题:
(1)蒸发溶剂前, (填“甲”或“乙”)是饱和溶液;
(2)b点对应的乙溶液是 (填“饱和溶液”或“不饱和溶液”);
(3)t℃时, (填“甲”或“乙”)的溶解度更大;
(4)甲的饱和溶液的质量分数是 (用含m、n的代数式表示)。

试题篮
()