生命的孕育和维系需要水,人类的日常生活和工农业生产离不开水,水是最常用的溶剂。
(1)电解水实验如图所示。x是电源的 极(填“正”或“负”),检验b试管中所得气体的方法是 。

(2)A、B两种物质的溶解度曲线如图1所示:20℃时,将A、B两种固体各50g,分别加入到盛有100g水的烧杯中,充分搅拌后现象如图2所示;升温到50℃时,A、B两种固体在水中的溶解情况如图3所示,(A、B两物质均不含结晶水)
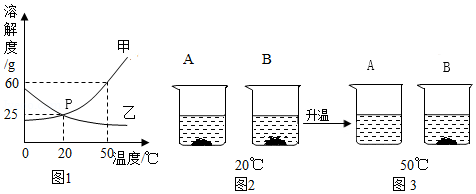
请回答下列问题:
①从20℃到50℃的变化过程中,一直处于饱和状态的是 (填“A”或“B”)的溶液。
②图1中能表示A物质溶解度随温度变化的曲线是 (填“甲”或“乙”)。
③图1中P点的含义 。
④图3中A溶液的溶质质量分数 (精确到0.1%)
溶液及物质的溶解性对我们的生产生活有重要意义。如图是三种物质的溶解度曲线,请回答:
(1)三种物质中, 的溶解度受温度影响最大。
(2)80℃时硝酸钠的溶解度是 g。
(3)将70℃时三种物质的饱和溶液分别降温至30℃,所得溶液为不饱和溶液的是 溶液。
(4)硝酸钾属于复合肥料,所含营养元素有 ,溶质质量分数为3%的硝酸钾溶液常用作无土栽培的营养液,配制这种营养液150kg,需要硝酸钾固体的质量 kg。

如表为氯化钠和氯化铵在不同温度时的溶解度,请回答下列问题
| 温度/℃ |
0 |
10 |
20 |
30 |
40 |
50 |
| NH 4Cl溶解度/g |
29.4 |
33.3 |
37.2 |
41.4 |
45.8 |
49.6 |
| NaCl溶解度/g |
35.4 |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
(1)由表中数据可知,溶解度随温度变化较大的物质是 ;
(2)20℃时,100g水最多能溶解NaCl g;
(3)向烧杯中加入100g水和49.0g氯化铵配成50℃的溶液,此时溶液为 溶液(填"饱和"或"不饱和");再冷却到20℃,烧杯中析出固体的质量为 g。
如图是A、B、C三种固体物质的溶解度曲线,据图作答:
(1)P点的意义是 。
(2)A、B、C三种物质中,溶解度随着温度的上升而减小的物质是 。
(3)t2℃时,将30g A物质加入到50g水中可形成 g溶液,此时溶液是 (填“饱和”或“不饱和”)溶液。
(4)将t2℃时A、B、C三种物质的饱和溶液均降温至t1℃,所得溶液中溶质质量分数由大到小的顺序是 。
(5)A物质中混有少量的C物质,若提纯A物质,可采用的结晶方法是 。

溶液对于自然界中的生命活动和人类生产活动具有重要的意义,多角度认识溶液有助于指导我们的生活。
(1)关于溶液的说法,正确的是 (填写标号)
A.溶液中各部分的性质相同B.均一、稳定的液体一定是溶液
C.浓溶液不一定是饱和溶液D.溶液加水稀释后溶质的质量变小
(2)表Ⅰ是部分物质在20℃时的溶解性;表Ⅱ是氯化钠、碳酸钠在不同温度时的溶解度。
离子 |
OH﹣ |
Cl﹣ |
CO32﹣ |
SO42﹣ |
K+ |
溶 |
溶 |
溶 |
溶 |
Mg2+ |
不 |
溶 |
微 |
溶 |
Ba2+ |
溶 |
溶 |
不 |
不 |
表Ⅰ空格中应填写 ;分析表Ⅱ可知,氯化钠和碳酸钠的饱和溶液溶质质量分数相同时的温度是 。
温度 (℃) |
0 |
10 |
20 |
30 |
40 |
氯化钠(g) |
35 |
35.5 |
36 |
36.5 |
37 |
碳酸钠(g) |
6 |
10 |
18 |
36.5 |
50 |
(3)简单解释“夏天晒盐、冬天捞碱”的科学原理 。
甲、乙、丙三种物质的溶解度曲线如图1所示。回答下列问题:

(1)当温度为 ℃时,甲、丙两种物质的溶解度相等。
(2)t3℃时,甲物质的饱和溶液中,溶质和溶液的质量比为 。
(3)若采用升温、恒温蒸发溶剂、增加溶质的方法都能使接近饱和的溶液变成饱和溶液,则该物质是 。
(4)R是甲,乙、丙三种物质中的一种,现用R作图2实验,①②中没有固体析出,③中有固体析出。根据图示信息,以下几种说法正确的是 (填标号)。

A.R是甲物质
B.①和②的溶液中,溶质质量相等
C.①②③中,只有③的上层清液是饱和溶液
D.①的溶液中溶质的质量分数比③的上层清液中溶质的质量分数小
如图是A、B、C三种物质的溶解度曲线,请认真分析并回答:
(1)t3℃时,A、B、C三种物质的溶解度由小到大的顺序为 。
(2)t2℃时,A、B、C三种物质的饱和溶液降温到t1℃时变为不饱和溶液的是 。
(3)当A中含有少量的B,可采用 (填“降温”或“蒸发”)结晶的方法提纯A物质。
(4)t3℃时,若用A、B两物质各50g配成饱和溶液,则所需加水的质量A B(填“>”,“<”,“=”号)

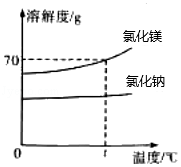
大连复州湾盐场是我国四大海盐场之一,利用传统的海水晒盐工艺,可得到氯化钠和氯化镁等物质。如图是氯化钠和氯化镁的溶解度曲线。
(1)两种物质中, 的溶解度受温度的影响较大。
(2)t℃时,氯化镁饱和溶液中溶质与溶剂的质量比为 。
(3)将接近饱和的氯化钠溶液变为饱和溶液,可采用的一种方法是 。
(4)海水晒盐是利用 的方法获得晶体。
甲、乙、丙三种物质在中形成的饱和溶液溶质的质量分数随温度变化如图所示,请回答下列问题:
(1)25℃时,甲物质的溶解度为 (答案保留一位小数)
(2)从乙溶液中获得乙晶体的方法是 (填“蒸发结晶”或“降温结晶”)
(3)将50℃甲的溶液降温至25℃,溶液为 (填“饱和溶液”或“不饱和溶液”)
(4)气体的溶解度随温度的变化规律与 (填“甲”、“乙”或“丙”)相似。

如图是甲、乙、丙三种物质的溶解度曲线。

(1)t 1℃时,三种物质的溶解度由大到小的关系为 。
(2)t 2℃时,甲、乙、丙三种物质的饱和溶液降温至t 1℃时为不饱和溶液的是 。
(3)现有含少量甲的乙固体,若要通过结晶法进行提纯乙(甲与乙不发生反应),现有下列实验步骤可供选择:
①取一定量的水将固体溶解②充分冷却后过滤③趁热过滤④加热蒸发至大部分晶体析出⑤加热蒸发至溶液接近饱和⑥停止加热用余热将溶液蒸干⑦用少量水洗涤晶体并烘干。合理的操作顺序为 (按顺序填编号)。
(4)t 3℃时,取等质量甲、乙、丙三种物质的饱和溶液,恒温蒸发一定质量的水(析出的晶体均不含结晶水),析出晶体的质量关系为甲=乙<丙,则剩余溶液的质量由大到小的关系为 。
(5)t 2℃时,配制甲、乙、丙三种物质的饱和溶液,一定相等的是 (填字母)。
A.溶质质量
B.溶剂质量
C.溶质质量分数
D.溶解度
甲、乙、丙三种物质的溶解度曲线如图所示,回答下列问题:
(1)t1℃时,甲、乙、丙三种物质溶解度由大到小的顺序是 。
(2)t3℃时,将20g物质丙加入50g水中充分溶解,并恢复到原温度,所得溶液的溶质质量分数为 。(结果保留到0.1%)
(3)在不改变溶质质量分数的前提下,将甲的不饱和溶液转化为饱和溶液的方法是 。
(4)下列说法不正确的是 (填字母序号)。
A.t1℃时,用甲、乙、丙三种固体配制等质量的饱和溶液,所需水的质量大小关系是乙>甲>丙
B.t2℃时,甲、丙两物质饱和溶液中所含溶质质量相等
C.将t3℃时的甲、丙的饱和溶液降低温度至t2℃,所得溶液的溶质质量分数相等
D.乙中混有少量甲,可以采用蒸发结晶的方法提纯乙

科学发现往往源于对实验现象的观察与研究。
(1)如图甲进行白糖溶解实验,根据图中现象判断:溶液② (填“是”“不是”或“可能是”)白糖的饱和溶液。

(2)如图乙所示,小科利用集气瓶收集从导管导出的氧气时,每隔一段时间,他就取出导管,再用带火星的木条放在瓶口验满。可是他始终没有观察到带火星木条复燃,小科实验操作中出现的错误是 。
氯化钠具有广泛的用途。

(1)生理盐水中的溶剂是 。
(2)生理盐水标签如图1所示。某同学欲配制标签中所标示的生理盐水一瓶,需要水的质量是 g。
(3)氯化钠主要存在于海水中,海水晒盐能够得到粗盐和卤水。卤水中含有MgCl2、KCl和MgSO4等物质,如图2是它们的溶解度曲线。分别将t2℃的MgCl2、KCl和MgSO4三种物质的饱和溶液降温到t1℃时,溶液中溶质质量分数从大到小的关系是 (填写字母序号)。
(4)某同学利用实验探究NaCl在水中的溶解度,所得数据记录如表。
序号 |
温度 |
水质量 |
加入NaCl质量 |
溶液质量 |
① |
20℃ |
25g |
9g |
34g |
② |
20℃ |
50g |
20g |
68g |
③ |
20℃ |
100g |
34g |
134g |
④ |
20℃ |
150g |
54g |
204g |
上述实验中,所得溶液为饱和溶液的是 (填数字序号)。
t℃时,将一定质量的甲、乙两种溶液进行恒温蒸发,蒸发溶剂的质量与析出晶体的质量之间的关系如图所示。回答下列问题:
(1)蒸发溶剂前, (填“甲”或“乙”)是饱和溶液;
(2)b点对应的乙溶液是 (填“饱和溶液”或“不饱和溶液”);
(3)t℃时, (填“甲”或“乙”)的溶解度更大;
(4)甲的饱和溶液的质量分数是 (用含m、n的代数式表示)。

试题篮
()