张老师在讲授溶液时,用固体M做了如下实验,图一中甲、乙、丙、丁是充分搅拌后静置的现象,请回答相关问题(忽略水的挥发):
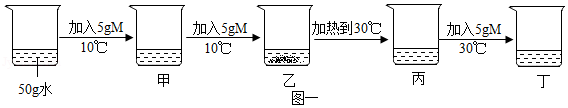
(1)上述烧杯中,溶液质量最大的是 (填序号)。
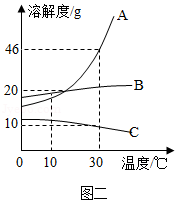
(2)上述实验可以判断物质M的溶解度曲线是图二对应的 (填序号)。
(3)甲、乙、丙烧杯中的溶液一定呈饱和状态的是 (填序号)。
(4)根据图二,若要使丁烧杯中的溶液恰好达到饱和状态,还需要加入 g的M固体。
如图是对某固体物质的溶液在一定温度下,进行恒温蒸发操作的实验记录,请回答:

(1)乙中的溶液为 (填“饱和”或“不饱和”)溶液。
(2)该固体物质在当时温度下的溶解度为 。
(3)甲、乙、丙、丁中溶液溶质质量分数的大小关系是 。
(4)给丁中的溶液升高温度时,固体逐渐消失,说明该物质的溶解度随温度升高而 (填“增大”或“减小”)。
下表是KNO3在不同温度时的溶解度,回答问题。
温度/℃ |
30 |
40 |
50 |
60 |
70 |
80 |
90 |
溶解度/g |
45.8 |
63.9 |
85.5 |
110 |
138 |
169 |
202 |
(1)影响固体物质溶解度大小的因素有 (填一种)。
(2)30℃时KNO3溶液的溶质质量分数的最大值是 (只列出表达式)。
(3)90℃时,将一定质量的KNO3溶液按图示进行操作:

90℃时的KNO3溶液是 (填“饱和”或“不饱和”)溶液。图中n的数值为 。
如表是NaCl和KNO 3在不同温度时的溶解度,回答问题
| 温度/℃ |
10 |
20 |
30 |
40 |
50 |
60 |
|
| 溶解度/g |
NaCl |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
37.3 |
| KNO 3 |
20.9 |
31.6 |
45.8 |
63.9 |
85.5 |
110.0 |
|
(1)两种物质中,溶解度受温度影响变化较大的是 。
(2)60℃时,按图示操作:

A中溶液是 (填"饱和"或"不饱和")溶液,C中溶液的总质量是 g。
(3)50℃时,将两种物质的饱和溶液各100g,分别加热蒸发10g水后,再恢复到50℃,剩余溶液的质量:NaCl溶液 (填"大于""等于"或"小于")KNO 3溶液。
如表为氯化钠和氯化铵在不同温度时的溶解度,请回答下列问题
温度/℃ |
0 |
10 |
20 |
30 |
40 |
50 |
4Cl溶解度/g |
29.4 |
33.3 |
37.2 |
41.4 |
45.8 |
49.6 |
NaCl溶解度/g |
35.4 |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
(1)由表中数据可知,溶解度随温度变化较大的物质是 ;
(2)20℃时,100g水最多能溶解NaCl g;
(3)向烧杯中加入100g水和49.0g氯化铵配成50℃的溶液,此时溶液为 溶液(填“饱和”或“不饱和”);再冷却到20℃,烧杯中析出固体的质量为 g。
分析处理图表中的信息是学习化学的一种重要方法.如表是氯化钠和硝酸钾在不同温度时的溶解度,仔细阅读并回答下列问题.
| 温度/℃ |
20 |
40 |
60 |
80 |
|
| 溶解度/g |
NaCl |
36.0 |
36.6 |
37.3 |
38.4 |
| KNO 3 |
31.6 |
63.9 |
110 |
169 |
|
(1)上述两种物质中, (填化学式)的溶解度受温度影响较大.
(2)在20℃时,将40g硝酸钾固体加入到100g水中,搅拌充分后得到是 溶液(填"饱和"或"不饱和")
(3)针对上述信息,甲、乙、丙三位同学分别得到如下结论,你认为说法正确的是 .
甲:40℃时,KNO 3溶液的溶质质量分数一定比NaCl溶液的溶质质量分数大.
乙:KNO 3饱和溶液中一定不能再溶解NaCl固体.
丙:KNO 3与NaCl溶解度相等时的温度一定在20℃﹣40℃之间.
如表是NaCl、KNO 3的部分溶解度,请回答下列问题:
| 温度/℃ |
10 |
20 |
30 |
40 |
50 |
60 |
| NaCl的溶解度/g |
35.8 |
36.0 |
36.63 |
36.6 |
37.0 |
37.3 |
| KNO 3的溶解度/g |
20.9 |
31.6 |
45.8 |
63.9 |
85.5 |
110.0 |
(1)NaCl、KNO 3的溶解度受温度变化影响大的是 .
(2)20℃时,氯化钠的溶解度为 ,取20g氯化钠放入50g水里,充分搅拌,可得到溶液 g.
(3)如图所示进行操作(每步均充分溶解),可得到饱和溶液的有 (填字母),溶质质量分数最大的是 (填字母).

甲烧杯中盛有30℃、溶质质量分数为20%的饱和硫酸铜溶液100克,进行如图所示实验(不考虑水分蒸发)。

(1)乙中溶液 (填“是”、“不是”或“可能是”)饱和溶液。
(2)丙中溶液的溶质质量分数为 %(结果保留一位小数)。
海水晒盐是海水在常温下蒸发得到氯化钠的过程.小柯用氯化钠溶液模拟该过程,如图:

(1)乙烧杯中的溶液 (选填"是"、"不是"或"可能是")氯化钠饱和溶液
(2)要加快氯化钠晶体析出,可以采用的方法是 .
如表是不同温度下KNO3的溶解度表。
温度(℃) |
0 |
20 |
40 |
溶解度(g/100g水) |
13.3 |
31.6 |
63.9 |
(1)称取30g KNO3固体时,在加一定量的KNO3固体后,发现托盘天平指针偏右,接下来的操作是 ,直到天平平衡;
(2)20℃时,将30g KNO3固体加入到盛有100g水的烧杯中,所得溶液是否饱和? ;
(3)要使20℃时的KNO3不饱和溶液变成饱和溶液,可采用 的方法。(写一种即可)
20℃时,向3个盛有50克水的烧杯中,分别加入一定质量的氯化钠,并充分溶解。根据下表实验数据回答。
实验编号 |
A |
B |
C |
加入氯化钠的质量(克) |
9 |
18 |
27 |
溶液质量(克) |
59 |
68 |
68 |
(1)实验所得3杯溶液中,属于不饱和溶液的是 (选填编号)。
(2)若将A杯中的溶液稀释成溶质的质量分数为0.9%的生理盐水,需加水 克。
如图是甲,乙、丙三种固体物质的溶解度曲线,据图回答下列问题:
(1)P点的含义是 。
(2)t 2℃时,把50g甲中加入到200g水中充分搅拌,静置,形成的是 溶液(填"饱和"或"不饱和")。
(3)稍微加热丙的饱和溶液即出现浑浊现象,其原因是 。
(4)除去甲中混有的少量乙,步骤是:加水溶解、加热浓缩、 、过滤、洗涤、干燥。
(5)将t 2℃时等质量的甲、乙两物质的饱和溶液分别降温至t 1℃,对所得溶液的叙述正确的是 (填字母序号)
A.溶剂质量:甲>乙 B.析出晶体质量:甲>乙
C.溶质质量分数:甲<乙
试题篮
()