甲、乙、丙三种物质的溶解度曲线如图所示。下列说法不正确的是( )
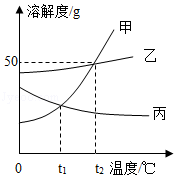
A.t 1℃时,甲和丙的溶解度相等
B.降低温度可使丙的不饱和溶液变成饱和溶液
C.甲中含有少量乙时,可采用降温结晶的方法提纯甲
D.t 2℃时,向80g水中加入20g甲,溶解后其溶质质量分数为20%
如图为甲、乙、丙三种固体物质的溶解度曲线。
(1)由图可知, 的溶解度随温度的升高而减小。
(2)将t1℃时等质量的甲、乙、丙三种物质的饱和溶液都升温到t2℃(溶剂不蒸发),所得溶液中溶质的质量分数由大到小的顺序是 。

溶液及物质的溶解性对我们的生产生活有重要意义。如图是三种物质的溶解度曲线,请回答:
(1)三种物质中, 的溶解度受温度影响最大。
(2)80℃时硝酸钠的溶解度是 g。
(3)将70℃时三种物质的饱和溶液分别降温至30℃,所得溶液为不饱和溶液的是 溶液。
(4)硝酸钾属于复合肥料,所含营养元素有 ,溶质质量分数为3%的硝酸钾溶液常用作无土栽培的营养液,配制这种营养液150kg,需要硝酸钾固体的质量 kg。

请根据如图A、B、C三种固体物质的溶解度曲线,回答下列问题:
(1)t1℃时,将20g A物质加入到50g水中,充分溶解并恢复至原温度,所得溶液中溶质与溶剂的质量比为 。
(2)若A物质中混有少量B物质,最好采用 的方法提纯A物质(填“降温结晶”或“蒸发结晶”)。
(3)t1℃时,将A、B、C三种物质的饱和溶液升温至t2℃(不考虑水的蒸发),所得溶液的溶质质量分数由大到小的顺序是 。
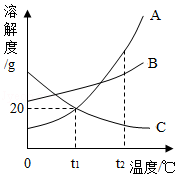
如图是a、b、c三种固体物质(均不含结晶水)的溶解度曲线图。请根据图示回答下列问题:
(1)20℃时,溶解度最大的是 。
(2)欲将c物质的饱和溶液变为不饱和溶液,可采用的方法是 (填“降低”或“升高”)温度。
(3)20℃时,向30g物质a中加入50g水,充分溶解并恢复到原温度,所得溶液中溶质的质量为 g。
(4)下列说法正确的是 。
A.当b中混有少量a时,可用蒸发结晶的方法提纯b
B.20℃时,用a、b、c三种固体配制等质量的饱和溶液,所需水的质量大小关系是b>a=c
C.将20℃的a、b、c三种物质的饱和溶液升温至t℃,所得溶液中溶质的质量分数大小关系为b>a>c
根据如图溶解度曲线,判断下列说法,其中错误的是( )

A.通过降温可将X从其饱和溶液中析出
B.海水晒盐利用了NaCl的溶解度受温度影响不大的特点
C.KNO3的溶解度随温度升高而增大
D.KNO3中含有少量NaCl,可采用降温结晶的方法进行提纯
甲、乙、丙三种物质的溶解度曲线如图1所示。回答下列问题:

(1)当温度为 ℃时,甲、丙两种物质的溶解度相等。
(2)t3℃时,甲物质的饱和溶液中,溶质和溶液的质量比为 。
(3)若采用升温、恒温蒸发溶剂、增加溶质的方法都能使接近饱和的溶液变成饱和溶液,则该物质是 。
(4)R是甲,乙、丙三种物质中的一种,现用R作图2实验,①②中没有固体析出,③中有固体析出。根据图示信息,以下几种说法正确的是 (填标号)。

A.R是甲物质
B.①和②的溶液中,溶质质量相等
C.①②③中,只有③的上层清液是饱和溶液
D.①的溶液中溶质的质量分数比③的上层清液中溶质的质量分数小
甲、乙两种物质溶解度曲线如图所示。下列叙述不正确的是( )

A.t3℃时,在100g水中加入20g甲,形成不饱和溶液
B.t2℃时甲、乙溶解度相同
C.甲、乙饱和溶液由t3℃降至t1℃,甲质量分数下降,乙质量分数升高
D.乙溶解度随温度的升高而降低
A、B、C三种固体物质的溶解度曲线如图所示,请完成下列问题:
(1)t3℃时,A、B、C三种物质的溶解度由大到小的顺序是 ;
(2)t2℃时,配制140g A物质的饱和溶液需要A物质的质量是 g;
(3)现有t1℃接近饱和的C溶液,在不改变溶液中溶质的质量分数的前提下,要使其变为饱和的溶液,可采取的一种措施是 ;
(4)若B中含有少量的A物质,可采用 方法提纯B。

如图是甲、乙、丙三种物质的溶解度曲线。

(1)t 1℃时,三种物质的溶解度由大到小的关系为 。
(2)t 2℃时,甲、乙、丙三种物质的饱和溶液降温至t 1℃时为不饱和溶液的是 。
(3)现有含少量甲的乙固体,若要通过结晶法进行提纯乙(甲与乙不发生反应),现有下列实验步骤可供选择:
①取一定量的水将固体溶解②充分冷却后过滤③趁热过滤④加热蒸发至大部分晶体析出⑤加热蒸发至溶液接近饱和⑥停止加热用余热将溶液蒸干⑦用少量水洗涤晶体并烘干。合理的操作顺序为 (按顺序填编号)。
(4)t 3℃时,取等质量甲、乙、丙三种物质的饱和溶液,恒温蒸发一定质量的水(析出的晶体均不含结晶水),析出晶体的质量关系为甲=乙<丙,则剩余溶液的质量由大到小的关系为 。
(5)t 2℃时,配制甲、乙、丙三种物质的饱和溶液,一定相等的是 (填字母)。
A.溶质质量
B.溶剂质量
C.溶质质量分数
D.溶解度
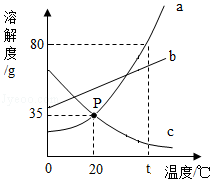
如图是a、b、c三种物质的溶解度曲线,回答下列问题:
(1)P点的含义是 ;
(2)t 2℃时,将50克a物质加入到100克水中,充分溶解后,所得溶液的质量是 克;
(3)若a中含有少量b,可用 的方法提纯a(选填"蒸发结晶"或"降温结晶");
(4)t 2℃时,等质量a、b、c三种物质的饱和溶液中溶剂质量由大到小的顺序为 。
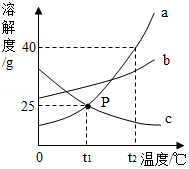
如图是甲、乙两种固体物质(均不含结晶水)的溶解度曲线,下列说法正确的是( )

| A. |
t 2℃时,甲的溶解度为70 |
| B. |
乙中含有少量的甲,可用蒸发溶剂的方法提纯乙 |
| C. |
t 2℃时,甲、乙两种物质的溶液分别降温到t 1℃,析出晶体的质量甲一定大于乙 |
| D. |
t 2℃时,甲的溶液降温到t 1℃,一定能得到甲的饱和溶液 |
根据KNO3和NaCl的溶解度曲线,回答下列问题。
(1)30℃时,KNO3和NaCl中溶解度较大的是 。
(2)20℃时,使接近饱和的KNO3溶液变为该温度下的饱和溶液的方法之一是 。
(3)为了使NaCl溶液中的溶质全部析出,应采用的方法是 结晶。

根据KNO3和NaCl的溶解度曲线,回答下列问题:
(1)10℃时,溶解度较小的是 (选填“KNO3”或“NaCl”);
(2)根据溶解度曲线分析,从海水中获得粗盐不采用降温结晶方法的原因是 ;
(3)下列说法正确的是 。
A.将不饱和的KNO3溶液变为饱和,可采用加KNO3的方法
B.20℃时,KNO3和NaCl两种饱和溶液中,所含溶质质量NaCl大于KNO3
C.30℃时,溶质质量分数为20%的KNO3溶液甲,降温至20℃得到溶液乙,再降温至10℃得到溶液丙,三种溶液中溶质的质量分数大小关系:甲=乙>丙

试题篮
()