水是生命之源,人类的日常生活和工农业生产都离不开水.
(1)生活中常用 来区分硬水和软水;
(2)小液滴分散到液体里形成的混合物叫做 ;
(3)下列做法有利于节约水资源或减少水体污染的是 (填序号,多选);
①农业和园林浇灌改为喷灌、滴灌②工业废水在接排入江河中
③生活污水集中处理和排放④为提高农作物产量,大量使用化肥农药
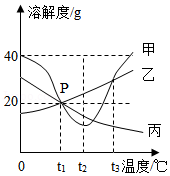
(4)甲、乙、丙三种物质的溶解度曲线图如下所示:

①T3℃时,三种物质的溶解度由大到小的顺序是: > > (选填“甲”、“乙”“丙”);
② (选填(“T1”、“T2”或“T3”)℃时,乙和丙的溶解度相等;
③T1℃时甲和丙的饱和溶液,升温到T2℃时仍然是饱和溶液的是 (选填“甲”或“丙”).
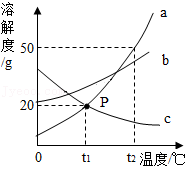
如图是A、B、C三种固体物质的溶解度曲线,请回答下列问题:
(1)P点表示的意义: 。
(2))t2℃时,A、B、C三种固体物质的溶解度大小顺序是: 。
(3)t2℃时,将60gA物质放入100g水中,充分溶解后,所得溶液是 (填“饱和溶液”或“不饱和溶液”),所得溶液的质量是 g。

甲、乙、丙三种固体物质的溶解度曲线如图所示,回答下列问题:
( 1 ) 25℃时,将50g甲固体加入到100g水中,充分溶解并恢复到原温度后,得到溶液的质量为 g。
(2)要使35℃时接近饱和的丙溶液变成该温度下的饱和溶液,可采用的一种方法是 。
(3)现有操作步骤:A.溶解;B.过滤;C.降温结晶;D.加热浓缩。若甲固体中含有少量乙,则提纯甲的操作步骤是 。(填字母序号)
(4)若将35℃时甲的饱和的溶液降温到变成25℃,则其溶液的溶质质量分数会 。(填字母序号)
A.变大 B.变小 C.不变。

甲、乙、丙三种物质(均不含结晶水)的溶解度曲线如图所示,回答下列问题:
(1)t1℃时P点的意义是 。
(2)t2℃时,比较甲、丙两物质的饱和溶液的溶质质量分数为:甲 丙(选填“>”、“=”或“<”)。
如图为甲、乙、丙三种固体物质的溶解度曲线,请回答下列问题。
(1)t1℃时,甲物质的溶解度是 g
(2)若乙中混有少量甲,提纯乙的方法是 (填“蒸发结晶”或“降温结晶)
(3)若溶液质量不变,将丙的饱和溶液变成不饱和溶液的方法是
(4)与t2℃时,向盛有20g甲物质的烧杯中加入50g水,充分搅拌后,所得溶液的质量是 克

甲、乙、丙三种物质在中形成的饱和溶液溶质的质量分数随温度变化如图所示,请回答下列问题:
(1)25℃时,甲物质的溶解度为 (答案保留一位小数)
(2)从乙溶液中获得乙晶体的方法是 (填“蒸发结晶”或“降温结晶”)
(3)将50℃甲的溶液降温至25℃,溶液为 (填“饱和溶液”或“不饱和溶液”)
(4)气体的溶解度随温度的变化规律与 (填“甲”、“乙”或“丙”)相似。

如图是a、b、c三种物质(均不含结晶水)的溶解度曲线,根据如图回答下列问题。
(1)P点的含义是 。
(2)t2℃时,a、b、c三种物质的溶解度由大到小的顺序是 。
(3)t1℃时,将25g a物质加入到100g水中,充分搅拌溶解后恢复到原温度,所得溶液中溶质与溶剂的质量比是 (最简整数比)。
(4)t2℃时,将a、b、c三种物质的等质量的饱和溶液降温至t1℃,下列说法正确的是 。
A.都是饱和溶液
B.溶质质量分数大小关系是:b>a>c
C.析出晶体质量最多的是a
早在二十世纪初,我国化学家侯德榜在氨碱法制纯碱的基础上,创立了更为先进的侯氏制碱法,生产出Na2CO3的同时得到副产品NH4Cl,促进了世界制碱技术的发展。实验测得Na2CO3和NH4Cl的溶解度曲线如图所示,下列有关说法错误的是( )

A.t1℃时,100g的Na2CO3饱和溶液中含溶质20g
B.t1℃时,NH4Cl的溶解度大于Na2CO3的溶解度
C.t2℃时,Na2CO3和NH4Cl的饱和溶液中溶质质量分数相同
D.将t2℃的NH4Cl的饱和溶液降温至.t1℃,有NH4Cl晶体析出
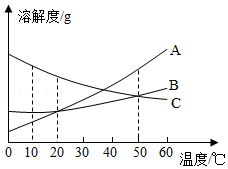
如图为A、B、C三种固体物质的溶解度曲线,根据图回答下列问题:
(1)10℃时,A、B、C三种物质中溶解度最大的是 。
(2)若A中含有少量B时,可用 的方法提纯A。
(3)将等质量的A、B、C饱和溶液由50℃降温到20℃时,所得溶液中溶质质量由大到小的顺序为 。
为探究硝酸钾的溶解性,进行了如图实验(见图Ⅰ),结合KNO3溶解度曲线(见图Ⅱ)判断,下列说法错误的是( )

A.溶液②、溶液④一定是饱和溶液
B.溶液①、溶液③一定是不饱和溶液
C.溶液②、溶液③的质量:③>②
D.溶液②、溶液③、溶液④的溶质质量分数:③>②=④
下表是氯化钠和硝酸钾在不同温度下的溶解度。
温度/℃ |
0 |
10 |
20 |
30 |
40 |
50 |
|
溶解度/g |
NaCl |
35.7 |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
KNO3 |
13.3 |
20.9 |
31.6 |
45.8 |
63.9 |
85.5 |
|
请回答下列问题:
(1)30℃时,硝酸钾的溶解度为 。
(2)使硝酸钾饱和溶液变为不饱和溶液,可采用的一种方法是 。
(3)50℃时,将80.0g一定质量分数的氯化钠溶液恒温蒸发,溶液的质量随蒸发水的质量变化关系如图所示,则a点溶液中溶质的质量为 。
(4)下列有关说法正确的是 (填标号)。
A.与氯化钠相比,硝酸钾的溶解度受温度影响较大
B.除去硝酸钾中混有的氯化钠,可采用降温结晶的方法
C.20℃时,向40.0g质量分数为25%的氯化钠溶液中加入10.0g氯化钠,可得到40%的氯化钠溶液
D.40℃时,分别向氯化钠和硝酸钾的饱和溶液中加入等量的水,所得溶液的质量分数可能相等

甲、乙两种物质的溶解度曲线如图。
(1)A点的含义是 。
(2)t2℃时,甲、乙两种固体各8g分别投入25g水中,充分搅拌。
① (填“甲”或“乙”)所得溶液为不饱和溶液,若保持温度不变,加入溶质 g可使其达到饱和。
②乙所得溶液中溶质质量分数为 %。

甲、乙、丙三种物质的溶解度曲线如图1所示。回答下列问题:

(1)当温度为 ℃时,甲、丙两种物质的溶解度相等。
(2)t3℃时,甲物质的饱和溶液中,溶质和溶液的质量比为 。
(3)若采用升温、恒温蒸发溶剂、增加溶质的方法都能使接近饱和的溶液变成饱和溶液,则该物质是 。
(4)R是甲,乙、丙三种物质中的一种,现用R作图2实验,①②中没有固体析出,③中有固体析出。根据图示信息,以下几种说法正确的是 (填标号)。

A.R是甲物质
B.①和②的溶液中,溶质质量相等
C.①②③中,只有③的上层清液是饱和溶液
D.①的溶液中溶质的质量分数比③的上层清液中溶质的质量分数小
如图1是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线。回答下列问题:

(1)t1℃时,甲、乙、丙三种物质的溶解度由大到小的顺序是 。
(2)P点表示,t2℃时,甲、丙两种物质的饱和溶液中,溶质与溶剂的质量比相等,均为 。
(3)t2℃时,取甲、乙两种固体各15g分别加入40g水中充分溶解,实验现象如图2所示,则烧杯a中溶解的物质是 (填“甲”或“乙”),所得溶液的质量为 g。
(4)当甲中含有少量的乙和丙(甲、乙、丙相互间均不发生化学反应)时,可采用 (填“降温”或“蒸发”)结晶的方法提纯甲物质。
(5)下列说法正确的是 (填字母序号)。
A.将甲物质的溶液由t3℃降温到t2℃,一定有晶体析出
B.将甲物质的饱和溶液由t2℃升温至t3℃时,其溶质质量分数增大
C.将t3℃时三种物质的饱和溶液恒温蒸发等质量的水,析出溶质的质量:甲>乙>丙
D.将t3℃三种物质的饱和溶液降温至t2℃,所得溶液的溶质质量分数:乙>甲=丙
试题篮
()