如图是a、b、c三种固体物质(不含结晶水)的溶解度曲线,下列说法正确的是( )

A.a的溶解度大于b的溶解度
B.P点表示t1℃时a、c两物质溶解度相等
C.将t1℃饱和的c溶液升温到t2℃,得到的是不饱和溶液
D.将t2℃,a、b、c三种物质的饱和溶液降温到t1℃时,所得溶液中溶质质量分数由大到小的顺序为:b>a=c
人类的日常生活和工农业生产离不开水。请回答:
(1)水__ ________(填“属于”或“不属于”)人类所需的六大基本营养素之一。
(2)含有较多可溶性钙、镁化合物的水叫做____________(填“软水”或“硬水”)。
(3)下列净化水的单一操作中,相对净化程度较高的是__________ _(填字母)。
A.静置沉淀 B.吸附沉淀 C.蒸馏
(4)水在通电的条件下可以分解,写出该反应的化学方程式__ __。
(5)甲和乙两种固体物质的溶解度曲线如右下图所示,回答下列问题:

①在__ __℃时,甲和乙两种物质的溶解度相等。
②将t1 ℃时等质量的甲和乙两种物质的饱和溶液分别降温到0 ℃,析出固体质量较少的是______(填“甲”或“乙”)。
③t2 ℃时,将60 g甲物质放入100 g水中,充分搅拌,所得溶液的溶质质量分数w(甲)与同温下乙物质的饱和溶液的溶质质量分数w(乙)大小关系为________ __(填字母)。
A.w(甲)<w(乙) B.w(甲)>w(乙)
C.w(甲)=w(乙) D.无法确定
KNO3、NaNO3、NaC1的溶解度曲线如图所示,下列说法正确的是( )

A.20℃时,KNO3的溶解度最大
B.0℃时,100 g NaNO3饱和溶液中含73 g NaNO3
C.从NaCl溶液中获取NaCl晶体时,必须采用冷却热饱和溶液的方法
D.分别将20℃的KNO3、NaNO3饱和溶液加热至80℃时,KNO3溶液溶质的质量分数小于NaNO3溶液
海水中的化学
(1)人们从海水中可以获得很多有用的物质。如①淡水、②食盐、③镁等。获取这几种物质主要通过物理变化的是 ;需要发生化学变化的是 (填编号)。

(2)海水中含有较多的硫酸钠。硫酸钠是制造纸浆、燃料稀释剂、医药用品等的重要原料。某硫酸钠粗品中含有少量的硫酸钙、硫酸镁,实验室进行提纯的流程如下:
回答下列问题:
①用氢氧化钠和碳酸钠除杂时,反应的化学方程式分别为
②氢氧化钠和碳酸钠如果添加过量了,可在滤液中加入适量 溶液除去。
③“后续处理”的主要操作是蒸发,为了获得纯净的硫酸钠,应蒸发至 (填序号)。
A.完全蒸干时停止加热
B.快干时停止加热,利用余热蒸干
C.有大量固体析出时停止加热,过滤弃去剩余的少量溶液
④已知硫酸钠的溶解度随温度变化的曲线如图所示。40℃时,硫酸钠的溶解度为 g。将该饱和溶液升高温度至90℃,观察到的现象是 。

甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线,如图所示,下列说法正确的是( )

A.三种物质的溶解度都随温度的升高而增大
B.P点表示t2℃时甲、丙两物质的溶解度相等
C.t1℃时,乙物质的饱和溶液溶质质量分数为30%
D.甲中含有少量乙,可采用蒸发结晶的方法提纯甲
衡量物质在水中溶解性强弱的物理量为
| A.物质在水中的溶解度 | B.饱和溶液的溶质质量分数 |
| C.物质的相对分子质量 | D.物质水溶液的密度 |
KNO3与KCl的溶解度曲线如图所示。下列说法正确的是( )
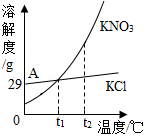
A.KNO3的溶解度比KCl的溶解度大
B.t1温度下的KCl的饱和溶液升温至t2,有晶体析出
C.A点所表示的KCl饱和溶液溶质的质量分数为29%
D.冷却热的KNO3饱和溶液可获得KNO3晶体
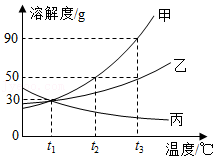
甲、乙、丙三种固体物质的溶解度曲线如图所示,下列相关说法正确的是( )

A.t2℃时甲和丙的溶解度都是60
B.t3℃时,甲、乙、丙三种物质的溶液中溶质质量分数一定是甲>乙>丙
C.将t3℃时甲和丙的饱和溶液降温到t2℃,两溶液的溶质质量分数相等
D.将t2℃时160g甲物质的饱和溶液降温到t1℃可析出20g固体(不含结晶水)
甲、乙、丙三种物质的溶解度曲线如图所示,回答下列问题:
(1)t1℃时,甲、乙、丙三种物质溶解度由大到小的顺序是 。
(2)t3℃时,将20g物质丙加入50g水中充分溶解,并恢复到原温度,所得溶液的溶质质量分数为 。(结果保留到0.1%)
(3)在不改变溶质质量分数的前提下,将甲的不饱和溶液转化为饱和溶液的方法是 。
(4)下列说法不正确的是 (填字母序号)。
A.t1℃时,用甲、乙、丙三种固体配制等质量的饱和溶液,所需水的质量大小关系是乙>甲>丙
B.t2℃时,甲、丙两物质饱和溶液中所含溶质质量相等
C.将t3℃时的甲、丙的饱和溶液降低温度至t2℃,所得溶液的溶质质量分数相等
D.乙中混有少量甲,可以采用蒸发结晶的方法提纯乙

根据下面NaNO3在不同温度时的溶解度表回答问题。(忽略溶解时的热量变化)
温度/℃ |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
溶解度/g |
80.8 |
87.6 |
94.9 |
103 |
113 |
124 |
136 |
149 |
(1)20℃时,将90g NaNO3固体加入盛有100g水的烧杯中,充分搅拌后,得到溶液的质量为 g。给烧杯加热,使溶液温度升至40℃时,溶液中溶质与溶剂的质量比为 。
(2)80℃时,将249g NaNO3饱和溶液降温至 时,溶液质量变为224g。
(3)50℃时,将200g溶质质量分数为50%的NaNO3溶液改为该温度下的饱和溶液,至少应向溶液中再加入 g NaNO3固体。
甲、乙、丙三种固体物质的溶解度曲线如图所示。据图回答下列问题:
(1)t2℃时,三种物质的溶解度由小到大的顺序是 。
(2)当温度为 ℃时,甲和丙两种物质的饱和溶液中溶质质量分数相等。
(3)若采用升温、恒温蒸发溶剂、增加溶质的方法都能使接近饱和的溶液变成饱和溶液,则该物质是 。
(4)将t3℃时甲和乙的饱和溶液分别降温至t2℃,析出晶体的质量关系为 。
A.甲>乙
B.甲=乙
C.甲<乙
D.无法确定
如图是甲、乙、丙三种固体物质的溶解度曲线。
(1)P点表示的含义为 。
(2)t1℃时,60g甲物质的饱和溶液升温到t2℃,再加 g甲物质,溶液仍然饱和。
(3)t2℃时,甲溶液中有少量丙,要提纯甲,用 结晶法。
(4)将t2℃时的甲、乙、丙的饱和溶液降温到t1℃,所得溶液中溶质的质量分数由大到小的顺序为 。

KNO3与NaCl的溶解度曲线如图所示。下列说法正确的是( )

A.NaCl的溶解度受温度影响的程度比KNO3的大
B.T1时,KNO3的溶解度比NaCl的大
C.T2时,KNO3与NaCl的饱和溶液质量分数相等
D.将T1时KNO3的不饱和溶液升温至T2,溶液变为饱和(不考虑溶剂蒸发)
T1℃时,将等质量的KNO3、KCl分别加入到各盛有100.0g水的两个烧杯中,充分搅拌后恢复到T1℃,现象如图1、2所示。下列说法正确的是( )

A.甲中加入的固体是KNO3
B.甲中溶液可能是该溶质的饱和溶液,乙中上层清液一定是该溶质的饱和溶液
C.将甲、乙中的物质混合,充分搅拌,一定有固体剩余
D.若将甲、乙的温度从T1℃升高到T2℃,两溶液中的溶质质量分数相等
根据表中内容回答下列问题。
温度/℃ 溶解度/g 物质 |
0 |
20 |
40 |
60 |
80 |
KNO3 |
13.3 |
31.6 |
63.9 |
110 |
169 |
NaCl |
35.7 |
36.0 |
36.6 |
37.3 |
38.4 |
Ca(OH)2 |
0.173 |
0.165 |
0.121 |
0.116 |
0.094 |
(1)随温度升高,Ca(OH)2溶解度的变化趋势是 (填“增大”、“减小”或“不变”)。
(2)根据上表推断硝酸钾与氯化钠溶解度相等时的温度范围是 。
(3)取KNO3、NaCl两种固体各36g分别放入20℃时的100g水中充分溶解,20℃时存在如图1所示的实验现象,烧杯b中溶解的物质是 ;烧杯a所得溶液溶质的质量分数是 (结果精确到1%),若要使其溶质质量分数增大可采用的方法是 。

(4)如图2所示,若向烧杯中加入足量的硝酸铵固体并使之充分溶解,在试管中可观察到的现象是 。
试题篮
()