如图是甲、乙两种固体的溶解度曲线,回答下列问题:
(1)甲、乙溶解度相等时的温度为 ℃。
(2)t2℃时,将70g乙的饱和溶液与30g水混合,所得溶液中溶质的质量分数为 。
(3)将t2℃时的甲、乙饱和溶液各100g,分别降温至t1℃,所得溶液中溶质的质量的关系为:甲 乙(填“>”“<”或“=”)。
(4)甲中混有少量的乙,若提纯甲应采用的方法是 。

下表是氯化钠和碳酸钠在不同温度时的溶解度,根据此表回答:
| 温度(℃) |
10 |
20 |
30 |
40 |
|
| 溶解度(g) |
NaCl |
35.8 |
36.0 |
36.3 |
36.6 |
| Na 2CO 3 |
12.2 |
21.8 |
39.7 |
53.2 |
|
| |
|
|
|
|
|
(1)氯化钠与碳酸钠溶解度相等的温度范围是 ;40℃时,分别配制表中两种物质的饱和溶液,其中溶质质量分数较大的物质是 。
(2)写出一种将碳酸钠的不饱和溶液转化为饱和溶液的方法 。
(3)碳酸钠固体中混有少量的氯化钠,提纯碳酸钠的操作是:加水溶解→ → →过滤、洗涤、烘干。
(4)20℃时,取1.8g碳酸钠粉末加入试管中,先滴入几滴水,观察到粉末结块;再继续加入10mL水,振荡,用手触摸试管壁,感觉到发烫。下列有关说法正确的是 (填序号)。
a.滴入几滴水,粉末结块是由于生成了晶体(Na 2CO 3•10H 2O),该晶体属于混合物
b.碳酸钠溶于水时放热
c.加入10mL水,振荡,会观察到固体部分溶解
d.向所得的溶液中加入几滴酚酞试液,溶液呈红色
下图是M、N两种物质的溶解度曲线。
(1)由图可以看出,M、N两种物质中,溶解度受温度影响较大的物质是 。
(2)M、N两物质的溶解度相等时的温度是 ℃。
(3)t2℃时,在两只各盛有100 g水的烧杯中,分别加入M、N各20 g,充分搅拌,该温度时能得到饱和溶液的是 。
现有编号为①、②、③的三个烧杯中均分别盛有100克水,20℃时向三个烧杯中分别加入36克、56克、76克的同种物质,充分溶解,实验结果如图所示,下列判断正确的是( )
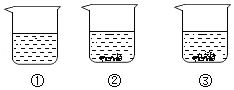
A.①中所得溶液一定是不饱和溶液
B.②③中所得溶液溶质的质量分数相等
C.若②中溶液升温到30℃,溶液的质量一定不变
D.若③中溶液恒温蒸发,溶质的质量分数一定变大
甲、乙两物质的溶解度曲线如图所示,下列说法错误的是
| A.t1℃时,甲、乙两物质的溶解度相等 |
| B.0~t1℃时,甲的溶解度小于乙的溶解度 |
| C.t2℃时甲和乙的饱和溶液溶质质量分数大小关系:乙>甲 |
| D.将甲的饱和溶液变为不饱和溶液,可采用升高温度的方法 |
分别向50g FeSO4和CuSO4溶液中,加入一定质量Mg粉恰好完全反应。随Mg粉消耗,Mg粉与溶液中FeSO4、CuSO4的质量变化见图。请读取图象信息并结合金属活动性顺序分析,下面说法不合理的是( )

A.反应前,溶液中溶质质量分数:FeSO4<CuSO4
B.反应后,两溶液底部分别析出的金属是Fe和Cu
C.反应后,两溶液底部析出金属的质量:Fe<Cu
D.反应后,若FeSO4和CuSO4对应新溶液的溶质质量分数分别为A、B,则A>B
下图是甲、乙两种固体物质的溶解度曲线,下列说法正确的是
| A.甲的溶解度大于乙的溶解度 |
| B.乙的不饱和溶液降温可变成饱和溶液 |
| C.二十摄氏度时,甲、乙两种物质的溶解度相同 |
| D.五十摄氏度时,甲的饱和溶液中溶质的质量分数为40% |
(10分)下图1是氯化铵和硫酸钠的溶解度曲线,回答下列问题:
(1)50℃时,30g氯化铵加入到50g水中不断搅拌,能形成 g溶液。
(2)60℃时,将氯化铵和硫酸钠各35g分别溶于100g水中形成溶液,冷却到20℃时,有晶体析出的是 。
(3)将40℃时上述两种物质的饱和溶液分别升温至45℃,所得氯化铵溶液的溶质质量分数 (填“>”、“<”或“=”)硫酸钠的溶质质量分数。
(4)80℃时,将氯化铵和硫酸钠各6g分别加入到盛有10g水的两支试管中,充分溶解后,可观察到如图2所示的现象。你认为图2中 (填“甲”或“乙”)物质是氯化铵。要使剩余的甲固体完全溶解,可以采取的方法是 。
小敏同学的化学复习笔记本上有如下记录,你认为不正确的是
| A.从溶解度曲线可以知道一定温度下某个物质的溶解度 |
| B.从金属活动性顺序表可以知道金属活泼性的强弱 |
| C.一定温度下,向溶液中加入溶质都会使其浓度增大 |
| D.配平化学方程式的依据是质量守恒定律 |
以下是Na2CO3、NaHCO3的溶解度表。下列说法中错误的是( )
0℃ |
10℃ |
20℃ |
30℃ |
40℃ |
50℃ |
60℃ |
|
Na2CO3的溶解度(g/100g水) |
7.1 |
12.5 |
21.5 |
39.7 |
49.0 |
48.5 |
46.0 |
NaHCO3的溶解度(g/100g水) |
6.9 |
8.1 |
9.6 |
11.1 |
12.7 |
14.5 |
16.4 |
A.40℃的饱和Na2CO3溶液升温到60℃,会析出晶体
B.60℃的NaHCO3溶液蒸干并充分灼烧,可得到NaHCO3晶体
C.30℃的溶质质量分数为25%的Na2CO3溶液降温到20℃,有晶体析出
D.20℃的饱和Na2CO3溶液中通足量CO2,生成的 NaHCO3会部分析出
下表列出了硝酸钾在不同温度下的溶解度。
| 温度(℃) |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
| 溶解度g/100g水 |
20.9 |
31.6 |
45.8 |
63.9 |
85.5 |
110 |
138 |
169 |
(1)从上表你可以得到信息是________________(写一条即可)。
(2)在20℃时,欲使一定量的硝酸钾不饱和溶液变为饱和溶液,可采取的两种措施分别是___________________________________、____________________________________。
甲、乙两物质的溶解度曲线如图2所示.现将两支分别装有甲、乙两物质饱和溶液的试管(底部均有少量未溶解的固体)浸入盛有水的烧杯里,然后向烧杯中加入适量的氢氧化钠固体,搅拌至完全溶解(如图1),此时对相应变化的判断正确的是( )

| A.甲溶液可能变成不饱和溶液 |
| B.盛乙的试管中未溶解的固体质量减少 |
| C.甲、乙两物质的溶解度都增大 |
| D.乙溶液中溶质质量分数减小 |
如图是硝酸钾和氯化铵的溶解度曲线图(如图1所示),某化学兴趣小组用物质R进行了如图2所示的实验,按要求完成以下问题。

(1)t1℃时将50g的氯化铵加入到80g的水中,此时所形成溶液的质量等于 克。
(2)①溶液的溶质的质量分数 ②溶液的溶质的质量分数(填“<”“>”或“=”)。
试题篮
()