下图是甲、乙两种固体物质的溶解度曲线。下列有关叙述不正确的是
| A.20℃时,甲物质的溶解度为40g |
| B.10℃时,甲、乙两种物质的溶解度相等 |
| C.30℃时,甲物质饱和溶液的质量分数为60% |
| D.除去甲物质中少量乙物质可采取蒸发结晶的方法 |
下图是甲、乙两种固体物质的溶解度曲线,下列说法错误的是
| A.10℃时,甲的溶解度小于乙的溶解度 |
| B.t℃时,甲、乙饱和溶液中溶质的质量分数一定相等 |
| C.除去甲物质中少量乙物质可采取降温结晶的方法 |
| D.将甲、乙饱和溶液的温度从30℃降到10℃时,甲析出晶体的质量大于乙析出晶体的质量 |
A、B、C三种固体物质的溶解度曲线如图所示。回答下列问题:
(1)写出图中P点表示的意义 ;
(2)t1℃时,将30gA物质放入50g水中,充分溶解后,所得溶液的质量是 g;
(3)当A中混有少量的B,常用的提纯方法是 ;
(4)将A、B、C三种物质的饱和溶液从t3℃降到t1℃,所得溶液中溶质的质量分数关系由大到小的顺序是 。

a、b两种物质的溶解度曲线如图所示.下列说法不正确的是
| A.15℃时,a、b 的溶解度均为20g |
| B.加水或升温均可使b的饱和溶液变为不饱和溶液 |
| C.将 30℃时a的饱和溶液降温至15℃,溶质的质量分数不变 |
| D.20℃时分别向100g 水中加入20ga和 b,升温至30℃,所得溶液均为饱和溶液 |
下表是KCl固体在不同温度时的溶解度.下列说法错误的是( )

| A. | KCl固体的溶解度随温度的升高而增大 |
| B. | 80 时, 固体的溶解度是51.1g |
| C. | 60 的 饱和溶液降温后会有晶体析出 |
| D. | 20 时, 饱和溶液的溶质质量分数为34.0% |
X、Y两种固体(均不带结晶水)物质的溶解度曲线如图所示,下列有关叙述错误的是
| A.X、Y两种固体物质都是易溶性物质 |
| B.降温t2℃X和Y的两杯饱和溶液到t1℃,析出的X一定比Y多 |
| C.向M点65gX溶液中加入15g X固体能得到t2℃X的饱和溶液 |
| D.降温(远高于t2℃)的X和Y的饱和溶液降温至0℃可初步提纯X |
溶解度曲线为我们定量描述物质的溶解性强弱提供了便利。请你根据下图的溶解度曲线回答下列问题:
(1)60℃时,分别将100g甲、乙的饱和溶液降温至40℃,析出固体质量甲 乙(填“>”、“<”或“=”)。
(2)60℃时,将80 g 甲物质放入100 g水中,所得溶液的溶质质量分数 。
(3)目前市场上销售的汽水饮料大多数是碳酸饮料,其中溶有二氧化碳气体。打开汽水瓶盖时,汽水会自动喷出来,这说明气体在水中的溶解度与 有关;喝了汽水后,常常会打嗝,这说明气体的溶解度还与 有关。
如图是四种物质的溶解度曲线,下列说法中正确的是( )

| A. |
20℃时,分别配制四种物质的饱和溶液,硫酸铵需要水的质量最少 |
| B. |
40℃时,向硫酸铵饱和溶液中加入适量氯化钾固体会析出硫酸钾晶体 |
| C. |
氯化钾饱和溶液的溶质质量分数一定小于氯化铵饱和溶液的溶质质量分数 |
| D. |
用30克硫酸钾固体最多可配制150克80℃的硫酸钾饱和溶液 |
我国制碱工业的先驱一侯德榜成功地摸索和改进了西方的制碱方法。下表为侯氏制碱法中部分物质的溶解度。
温度/℃ |
10 |
20 |
30 |
40 |
|
溶解度/g |
Na2CO3 |
12.2 |
21.8 |
39.7 |
48.8 |
NaCl |
35.8 |
36.0 |
36.3 |
36.6 |
|
NaHCO3 |
8.2 |
9.6 |
11.1 |
12.7 |
|
(1)由上表可知,在10℃﹣40℃之间溶解度随温度变化最小的物质是 (填名称)。
(2)40℃时,将等质量的三种表中物质的饱和溶液降温至20℃,所得溶液中溶质的质量分数由大到小的顺序是 (用化学式表示)。
(3)侯氏制碱法制得的碱为纯碱,纯碱的化学式为 。
(4)制碱原理为向饱和的NaCl溶液中通入足量NH3和CO2生成 NaHCO3晶体和NH4Cl,NaHCO3加热分解即制得纯碱。
①生成 NaHCO3的化学方程式为 。
②结合上表分析,析出 NaHCO3晶体的原因可能有 (填序号)。
A.溶剂质量减少
B.同温下 NaHCO3溶解度小于NaCl
C.生成的NaHCO3质量大于消耗的NaCl质量
下图是甲、乙两种固体的溶解度曲线,下列说法正确的是
| A.甲的溶解度等于乙的溶解度 |
| B.升高温度可以将甲的不饱和溶液变为饱和溶液 |
| C.20 ℃时,100 g乙的饱和溶液中溶质质量是30 g |
| D.40 ℃时,分别用100g水配制甲、乙的饱和溶液,所需甲的质量大于乙的质量 |
认真分析下列各图,回答相关问题:
(1)根据图1分析,20℃时,将20g NaCl加入50g水中形成溶液的质量为____________。
(2)图2中打开汽水瓶冒出大量气泡,说明气体的溶解度与____________有关。
(3)在图3所示的烧杯中加入一定量的硝酸铵,溶解后甲试管内出现的现象是______________;乙试管内的溶液是____________(填“饱和”或“不饱和”)溶液。
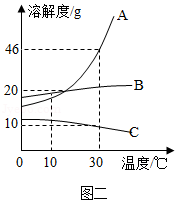
张老师在讲授溶液时,用固体M做了如下实验,图一中甲、乙、丙、丁是充分搅拌后静置的现象,请回答相关问题(忽略水的挥发):
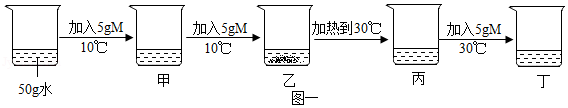
(1)上述烧杯中,溶液质量最大的是 (填序号)。
(2)上述实验可以判断物质M的溶解度曲线是图二对应的 (填序号)。
(3)甲、乙、丙烧杯中的溶液一定呈饱和状态的是 (填序号)。
(4)根据图二,若要使丁烧杯中的溶液恰好达到饱和状态,还需要加入 g的M固体。
除去下列物质中的少量杂质,所用试剂或方法不正确的是
| 选项 |
物质 |
杂质 |
试剂或方法 |
| A |
NaCl固体 |
泥沙 |
加水溶解、过滤、蒸发 |
| B |
KCl溶液 |
K2CO3 |
滴加CaCl2溶液至不再产生沉淀 |
| C |
NaCl溶液 |
稀盐酸 |
适量的K2CO3溶液 |
| D |
N2 |
O2 |
通过红热的铜粉 |
学习了化学以后,要能运用化学知识解释日常生活中的现象,分析和解决生产生活中的实际问题。下列说法中错误的是
| A.搅拌能加快蔗糖在水中的溶解,其原因是增大了蔗糖的溶解度 |
| B.天气闷热时,鱼会在接近水面处游动,原因是温度升高气压变小,氧气的溶解度减小 |
| C.铜器上生成的绿色物质可用稀盐酸除去 |
| D.汽油和洗衣粉都能洗去衣服上的油迹,但原理不同 |
试题篮
()