欲测定一瓶标签破损的稀硫酸的溶质质量分数,现取30g稀硫酸样品于烧杯中,将15%的NaOH溶液逐滴加入烧杯中,边加边搅拌,随着NaOH溶液的不断加入,溶液pH的变化如图所示。回答下列问题:
(1)a点溶液中的溶质是 (填化学式)。
(2)计算该稀硫酸的溶质质量分数。(写出计算过程,结果精确到0.1%)

化学兴趣小组要测定制作叶脉书签所用氢氧化钠溶液的浓度。取40g该氢氧化钠溶液于锥形瓶中,加入数滴酚酞溶液后再滴加质量分数为10%的稀硫酸,当锥形瓶中液体由红色恰好变成无色时,消耗稀硫酸的质量为49g。试计算该氢氧化钠溶液中溶质的质量分数。
小明用石灰石测定某稀盐酸中溶质的质量分数,向盛有100g稀盐酸的烧杯中依次加入石灰石粉末(杂质不参加反应),充分反应后,记录实验数据见下表。请计算:
| 实验次数 |
第一次 |
第二次 |
| 石灰石粉末质量/g |
15 |
15 |
| 烧杯中物质总质量/g |
109.5 |
121.2 |
(1)共生成二氧化碳 g。
(2)所用稀盐酸中溶质的质量分数。
取一定量的硫酸铵固体于烧杯中,加入100g氢氧化钠溶液,加热,恰好完全反应。反应后将溶液蒸干,得到7.1g固体。该反应的化学方程式为:(NH4)2SO4+2NaOH═Na2SO4+2H2O+2NH3↑.请计算:
(1)生成氨气的质量。
(2)氢氧化钠溶液中溶质的质量分数。
氯可形成多种含氯酸盐,广泛应用于杀菌、消毒及化工领域。实验室中制备KClO3的化学反应方程式为3Cl2+6KOH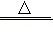 5KCl+KClO3+3H2O。若用Cl2与200g的KOH溶液恰好完全反应,反应后溶液质量为221.3g。计算:
5KCl+KClO3+3H2O。若用Cl2与200g的KOH溶液恰好完全反应,反应后溶液质量为221.3g。计算:
(1)参加反应的氯气的质量为 g。
(2)所用KOH溶液中溶质的质量分数是多少?
实验室用34g过氧化氢溶液和2g二氧化锰混合制取氧气。完全反应后剩余物质总质量为35.2g。请计算:
(1)生成氧气的质量为 g。
(2)求所用过氧化氢溶液溶质的质量分数。(根据化学方程式进行计算,写出计算过程)
某化学兴趣小组的同学在社会实践中,对废品回收站中废弃电器零部件黄铜(铜、锌合金)中铜的含量产生了兴趣,为了测定该黄铜中铜的含量,小组同学将黄铜带入化学实验室,称取该黄铜样品50克放入指定容器中,然后分四次加入稀硫酸,实验数据记录如表:
| 加入次数 |
第1次 |
第2次 |
第3次 |
第4次 |
| 加入稀硫酸质量(g) |
100 |
100 |
100 |
100 |
| 充分反应后剩余固体质量(g) |
43.5 |
37 |
35 |
n |
请回答下列问题:
(1)根据实验数据分析,n的数值应该为 ;
(2)黄铜样品中铜的质量分数为 ;
(3)所用稀硫酸溶质的质量分数。(写出计算过程)
过氧化氢溶液俗称双氧水,是一种常见消毒剂。实验员用以下方法制取了少量过氧化氢溶液,在低温下,向56.4g某浓度的稀硫酸中逐渐加入一定量的过氧化钡(BaO 2),发生的化学反应为BaO 2+H 2SO 4═BaSO 4↓+H 2O 2,当恰好完全反应时生成23.3g沉淀。计算:
解:(1)设加入BaO 2的质量为X,生成的H 2O 2质量为Y,需要加入水的质量为Z
BaO 2 +H 2SO 4 ═BaSO 4↓+H 2O 2
169 233 34
X 23.3g Y
X=16.9g;Y=3.4g
(2)反应后所得溶液中溶质质量分数为: 6.8%;
(3)设需加入水的质量为Z
(16.9g+56.4g﹣23.3g)×6.8%=(16.9g+56.4g﹣23.3g+Z)×3%
Z=63.3g
答:(1)加入BaO 2的质量是16.9g;
(2)反应后所得溶液中溶质质量分数6.8%;
(3)需加入水的质量63.3g。
农业生产上常用一定溶质质量分数的氯化钠溶液进行选种。实验小组取该溶液36g,向其中滴加硝酸银溶液至不再产生沉淀为止,过滤、洗涤、干燥后,用电子秤称得沉淀质量为14.35g。
(1)配制选种所用氯化钠溶液的步骤:计算、称量、 、溶解。
(2)计算该氯化钠溶液中溶质的质量分数(写出计算讨程)。
为测定某赤铁矿中Fe2O3的含量,取10g该赤铁矿样品于烧杯中,向其中加入100g稀盐酸,恰好完全反应,测得剩余固体的质量为2g。(杂质不溶于水也不与酸反应)
请完成下列分析及计算:
(1)10g样品中杂质的质量为 g。
(2)计算稀盐酸中溶质的质量分数。
某化学兴趣小组的同学进行了如图所示实验。

请根据图示信息计算:
(1)实验中产生氢气的质量是 g。
(2)实验中所用稀硫酸溶质的质量分数是多少(要求书写计算过程)?
某同学用质量分数为15%的稀硫酸处理某造纸厂含NaOH的碱性废水样品:
(1)用9.2g质量分数为98%的浓硫酸能配制上述稀硫酸 g(计算结果保留整数)。
(2)若上述造纸厂废水75g能与9.8g 15%的稀硫酸恰好反应(设只发生NaOH与硫酸的反应),试计算该废水中NaOH的质量分数(写出计算过程,结果精确到0.1%)。
某实验小组验证“Fe+Ag2SO4═FeSO4+2Ag”反应并进行了如下探究。已知银粉为黑色,22℃时Ag2SO4的溶解度为0.8g。
①22℃时,向盛有硫酸银饱和溶液的烧杯中加入过量铁粉,搅拌静置,观察到溶液变为黄色并逐渐加深。
②静置3小时后观察,烧杯底部仍有黑色粉末,溶液黄色几乎消失。
③用pH试纸检测Ag2SO4、FeSO4溶液,测得pH均小于7。
回答下列问题:
(1)22℃时,硫酸银饱和溶液显 性(填“酸”“碱”或“中”),其溶质质量分数为 。(列出计算式即可)
(2)取步骤①上层的黄色溶液少许滴加盐酸,观察到白色沉淀,该沉淀的化学式为 。
(3)某同学由步骤②中“仍有黑色粉末”得出Fe比Ag活泼的结论。小组同学讨论后认为思维不严密,因为黑色粉末不一定含Ag,还可能是 ,需要进一步实验才能得出结论,该实验方案是:取黑色粉末少许, 。(补充完实验方案)
(4)溶液呈黄色是因为含有Fe3+离子。小组对Fe3+产生的原因作出如下假设:
a.可能是铁粉表面有氧化物,可产生Fe3+;
b.空气中的O2能与Fe2+反应,可产生Fe3+;
c.溶液中存在 离子能与Fe2+反应,可产生Fe3+。
请设计实验证明假设a、b不是产生Fe3+的主要原因。实验方案是:向同样的铁粉中加入FeSO4溶液,振荡静置,观察到 时即可证明。
为测定某盐酸的溶质质量分数,取200g样品于烧杯中,将50g碳酸钠溶液分为5等份,分5次加入盛有样品的烧杯中。测出每次反应后溶液的总质量,实验数据如下表:
第一次 |
第二次 |
第三次 |
第四次 |
第五次 |
|
加入Na2CO3溶液的质量 |
10g |
10g |
10g |
10g |
10g |
反应后溶液的质量 |
208.9g |
217.8g |
226.7g |
235.6g |
245.6g |
请根据实验数据计算盐酸的溶质质量分数。
试题篮
()