2019 年 5 月湖南省第七届矿博会在郴州市隆重举行,展厅上展出了各种矿物,其中有一 枚黑色的陨石引起了大家的兴趣。查阅资料获知,陨石的主要成分是铁和铁的化合物。
(1)通常情况下碳粉和铁粉都是黑色,检验碳粉中是否含有铁粉既可用物理方法又可 用化学方法:
①物理方法是 ;
②化学方法是 。
(2)常见铁的氧化物有 FeO、Fe 2O 3、 。(填化学式)
(3)铁制品在潮湿的空气中易生锈,实际上是铁与空气中的氧气、 等发生化 学反应的过程,请举出一例防止铁制品锈蚀的方法 。
实验员小明取一小块陨石进行了研究,研究过程如图所示:
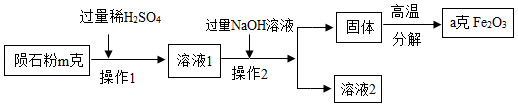
(4)图中操作 2的名称是 。
(5)溶液2中的溶质是 。(写化学式)
(6)陨石中含铁元素的质量分数为 。
金属及其化合物在生产生活中有广泛的应用。

(一)金属的应用和防护
(1)用不锈钢、合成橡胶、氧化镁等材料制造的飞机轮胎属于 材料。
(2)航空煤油是飞机的燃料,它主要是由 炼制的。
(3)铁易生锈,提出防止铁生锈的一种方法 。
(4)特种钢中含有少量Mn、MnO2和Al粉混合在高温下反应可得到Mn,该反应的化学方程式为 。
(5)Mg(OH)2受热分解生成高熔点的MgO.Mg(OH)2可用作阻燃剂,其主要原理是 (选填序号)。
a.分解吸热,降低可燃物着火点 b.MgO覆盖燃烧物,隔绝氧气
(二)制备还原性铁粉
实验室利用废铁屑(含少量Fe2O3)为原料制备还原性铁粉的流程如下:
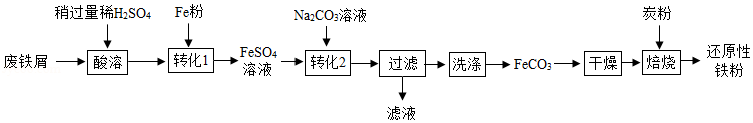
(1)Fe粉可使“酸溶”产生的Fe2(SO4)3转化为FeSO4,该反应的化学方程式为 。
(2)检验FeCO3已洗净的方法:取最后一次洗涤后的滤液,先加入一定量稀盐酸,再滴加 溶液,无明显现象。
(3)“干燥”时有少量FeCO3发生下列转化:FeCO3 FeOOH+CO2,该转化的化学方程式为 。
(4)“焙烧”前,应将炭粉与“干燥”所得固体均匀混合,目的是 。
(三)测定还原性铁粉的组成
还原性铁粉中含有少量FexCy,小组同学在老师的指导下进行以下实验。
资料:①Fe,FexCy在加热时与O2反应能生成相应氧化物。
②FexCy不与酸反应。
实验1:取29.52g样品,加入足量稀H2SO4,充分反应后生成1.00gH2。
实验2:另取29.52g样品,按如图进行实验。
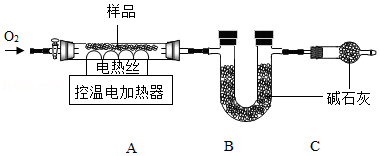
表:装置A和B的质量变化
装置 |
A |
B |
反应前 |
300.00 |
400.00 |
反应后 |
m |
400.44 |
实验后A中固体全部变为红棕色,装置A、B的质量变化如上表。
(1)装配好装置后,实验前先要 。
(2)装置C的作用是 。
(3)FexCy中,x:y= 。表中m的值是 。
反思:若用空气替代O2进行实验,测得x:y的值偏大,可能的原因是 。
2017年4月,“航母”下水,开拓中国新蓝海。
(1)“航母”舰体材料为合金钢,国产航母使用的“超级钢”具有极佳的抗压性、延展性和焊接性。合金钢是 (填序号)
a.合成材料 b.复合材料 c.无机材料
(2)“航母”升降机可由铝合金制造,用石墨作电极在高温条件下电解熔融氧化铝,在阴极和阳极区分别得到A1和O2,阳极区使用的石墨易消耗的原因是 。
(3)“航母”螺旋浆可由铜合金制造。铜合金比铜的硬度 (填“大”或“小”),铜比铁在海水中耐腐蚀的原因是 。
(4)由生铁炼钢时,硅(Si)与氧化亚铁在高温条件下反应生成二氧化硅和铁,该反应的化学方程式为 。

铁及其化合物在生产生活中有广泛的应用。
(一)铁的应用和防护
(1)某麦片中含微量铁粉,食用后铁粉与胃酸反应转化为人体可吸收的铁元素,反应的化学方程式为 。
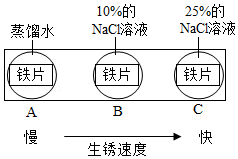
(2)铁锈主要成分是Fe 2O 3•nH 2O,铁生锈主要与空气中的 有关。
(3)如图实验说明NaCl在铁生锈中的作用是 。
(4)铁生锈的次要过程:Fe 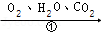 FeCO 3•nH 2O
FeCO 3•nH 2O  FeCO 3
FeCO 3
写出Fe转化为总反应的化学方程式 。
(5)为防止铁生锈,可对铁制品进行"发蓝"处理,使其表面生成致密氧化物(其中Fe、O元素质量比为21:8)保护膜,该氧化物的化学式为 。
(二)废铁的再利用
黄钠铁矾[NaFe x(SO 4) y(OH) z]是一种高效净水剂。用废铁屑(主要成分为Fe,含少量Fe 2O 3和FeCO 3)制备黄钠铁矾的主要流程如图:
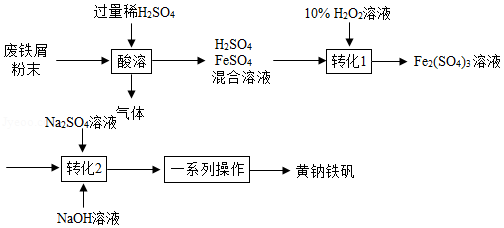
(1)将废铁屑研磨成粉末的目的是 。
(2)"酸溶"时H 2SO 4与Fe、FeCO 3反应,还发生反应的化学方程式有 和Fe+Fe 2(SO 4) 3=3FeSO 4。
(3)"转化1"发生反应的化学方程式为 。反应时温度不宜过高的原因是 。
(三)黄钠铁矾组成确定
称取9.70g黄钠铁矾,用如图装置进行热分解实验。
【资料】
①NaFe x(SO 4) y(OH) z在T 1℃分解会生成H 2O(气态),提高温度至T 2℃继续分解产生SO 3气体,并得到Fe 2O 3和Na 2SO 4。
②浓硫酸可用于吸收SO 3。
(1)装配好实验装置后,先要 。
(2)分别控制温度在T 1℃、T 2℃对A中固体加热。
①控制温度在T 1℃加热,实验后测得B装置质量增加1.08g。
②用D装置替换B装置,控制温度在T 2℃,加热至反应完全。
③T 1℃、T 2℃时,加热后均通入一段时间N 2,目的是 。
(3)反应完全后,将A装置中固体溶于足量水,过滤、洗涤、烘干得4.80g固体,将滤液蒸干得1.42g固体(不含结晶水)。
结论:NaFe x(SO 4) y(OH) z中,x:y:z= 。
反思:若该实验过程中缺少C装置,则x:z的值 (选填"偏大""偏小"或"不变")。
材料是人类赖以生存和发展的重要物质,目前使用量最多的金属材料仍然是钢铁

(一)铁材料的有关知识
1.人类使用金属先后经历了"青铜"、"铁器"时代,直到近代才开始大量使用铝材料.
这也反映出Cu、Fe、Al三种金属的活动性由强到弱的顺序是 .
2.钢铁材料通常分为生铁和钢.如图1是我国1997年发行的纪念钢产量首次突破1亿吨的邮票.邮票通常密封保存在聚乙烯塑料袋中
①以上叙述中不涉及到的材料是 (选填序号).
A.合金 B.无机非金属材料 C.有机合成材料
②以赤铁矿为原料冶炼铁反应的化学方程式
③钢铁露置在空气中易生锈,请提出防止其生锈的一种措施 .
(二)铁及其化合物的实验
1.将Fe粉溶于稀H 2SO 4,此反应属于 (填基本反应类型).用点燃法检验生成的H 2前必须 .
2.向上述反应后的溶液中滴加NaOH溶液,生成白色Fe(OH) 2沉淀,随后沉淀变为灰绿色.
①生成Fe(OH) 2反应的化学方程式 .
②白色沉淀变为灰绿色的原因之一是部分Fe(OH) 2接触空气生成Fe(OH) 3,反应的化学方程式 .生成的Fe(OH) 3分解为Fe 2O 3.
③过滤、洗涤、低温干燥得到灰绿色固体,其组成为2FeSO 4•2Fe(OH) 2•Fe 2O 3〔相对分子质量为644].能证明固体已洗净的方法为 .
(三)灰绿色固体的热分解实验
兴趣小组称取此固体6.44g,在科研人员的指导下用如图2装置进行热分解实验.
【查阅资料】
①Fe(OH) 2在150℃~200℃时完全分解为FeO;
②FeSO 4在450℃~500℃时完全分解为Fe 2O 3,2FeSO 4 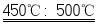 Fe 2O 3+SO 2↑+SO 3↑.
Fe 2O 3+SO 2↑+SO 3↑.
1.加热前后及过程中均通入N 2,加热前通N 2的目的是 .
2.控制温度在不同的范围对A中样品加热,测得剩余固体质量随温度的变化如图3所示.B装置中浓硫酸只能吸收SO 3和H 2O,当加热到t 1℃时,装置C中的现象为 .
①图3中E点对应的m 1= .
②图3中F点对应物质中Fe 2O 3的质量为 g.
③科研人员将F点所得剩余固体隔绝空气,在密闭容器中加热到1400℃,得到纯净的磁性Fe 3O 4.已知加热过程中发生两个反应,且反应前后固体总质量不变.请写出其中一个反应的化学方程式 .
汽车制造是盐城市的支柱经济产业之一,汽车制造过程中要用到大量的铁、铜、铝等金属材料,请按要求填空.(1)汽车制造中用得最多的金属材料是钢.钢 (填"是"或"不是")纯金属.车体表面喷漆不仅美观,而且可有效防止钢铁与 接触而生锈.炼铁的原理是利用一氧化碳与氧化铁反应还原出铁,反应的化学方程式为 .
(2)汽车电路中的导线大都是铜芯的,这主要是利用了铜的 性.将赤铜矿(主要成分Cu 2O)和辉铜矿(主要成分Cu 2S)混合焙烧可得到铜,请将反应的方程式补充完整:2Cu 2O+Cu 2S  6Cu+ .
6Cu+ .
(3)铁、铜、铝三种因素在地壳中的含量多少顺序为Al>Fe>Cu,但三种金属被人类发现和利用的时间是铜最早,而铝最晚,这跟它们的 有关.铝具有很好的抗腐蚀性能,原因是 .
(4)镁铝合金是汽车制造中的重要材料之一.为测定某镁铝合金(只含镁、铝两种元素)的组成成分,某学习小组取3.9g合金粉末加入100.0g过量的盐酸中,向充分反应后的溶液中加入过量20.0%的氢氧化钠溶液,最终得到沉淀2.9g.
【质疑】通过讨论,大家认为得到的沉淀质量数据可能有问题.按初中化学现有知识计算,沉淀的质量至少为 g.
【探讨】经向老师请教,同学们了解到氢氧化铝沉淀可与氢氧化钠溶液反应,产生可溶性的偏铝酸钠,反应如下:NaOH+Al(OH) 3═NaAlO 2+2H 2O
【计算】若已知产生沉淀的质量与加入氢氧化钠溶液的质量关系如图所示,请计算:
①该合金中镁的质量为 g;铝的质量为 g.
②加入的盐酸溶质质量分数为多少?(请写出计算过程)

试题篮
()