铁及其化合物在生产生活中有广泛的应用。
(一)铁的应用和防护
(1)某麦片中含微量铁粉,食用后铁粉与胃酸反应转化为人体可吸收的铁元素,反应的化学方程式为 。
(2)铁锈主要成分是Fe 2O 3•nH 2O,铁生锈主要与空气中的 有关。
(3)如图实验说明NaCl在铁生锈中的作用是 。
(4)铁生锈的次要过程:Fe 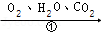 FeCO 3•nH 2O
FeCO 3•nH 2O  FeCO 3
FeCO 3
写出Fe转化为总反应的化学方程式 。
(5)为防止铁生锈,可对铁制品进行"发蓝"处理,使其表面生成致密氧化物(其中Fe、O元素质量比为21:8)保护膜,该氧化物的化学式为 。
(二)废铁的再利用
黄钠铁矾[NaFe x(SO 4) y(OH) z]是一种高效净水剂。用废铁屑(主要成分为Fe,含少量Fe 2O 3和FeCO 3)制备黄钠铁矾的主要流程如图:
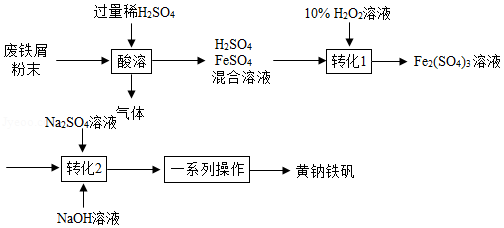
(1)将废铁屑研磨成粉末的目的是 。
(2)"酸溶"时H 2SO 4与Fe、FeCO 3反应,还发生反应的化学方程式有 和Fe+Fe 2(SO 4) 3=3FeSO 4。
(3)"转化1"发生反应的化学方程式为 。反应时温度不宜过高的原因是 。
(三)黄钠铁矾组成确定
称取9.70g黄钠铁矾,用如图装置进行热分解实验。
【资料】
①NaFe x(SO 4) y(OH) z在T 1℃分解会生成H 2O(气态),提高温度至T 2℃继续分解产生SO 3气体,并得到Fe 2O 3和Na 2SO 4。
②浓硫酸可用于吸收SO 3。
(1)装配好实验装置后,先要 。
(2)分别控制温度在T 1℃、T 2℃对A中固体加热。
①控制温度在T 1℃加热,实验后测得B装置质量增加1.08g。
②用D装置替换B装置,控制温度在T 2℃,加热至反应完全。
③T 1℃、T 2℃时,加热后均通入一段时间N 2,目的是 。
(3)反应完全后,将A装置中固体溶于足量水,过滤、洗涤、烘干得4.80g固体,将滤液蒸干得1.42g固体(不含结晶水)。
结论:NaFe x(SO 4) y(OH) z中,x:y:z= 。
反思:若该实验过程中缺少C装置,则x:z的值 (选填"偏大""偏小"或"不变")。
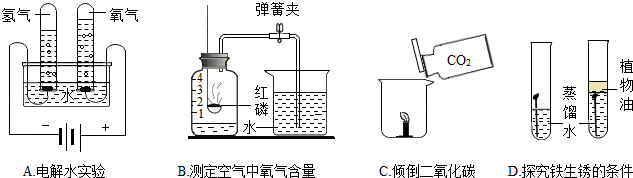
如图是一些探究实验,请回答相关问题。
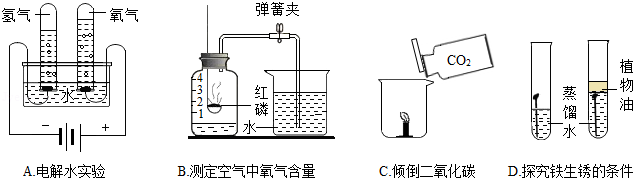
(1)A实验水中加入少量氢氧化钠溶液的作用是 。
(2)B实验中导致测量结果小于  的原因可能是 (答一点即可)。
的原因可能是 (答一点即可)。
(3)C实验可验证二氧化碳的主要物理性质是 。
(4)D实验验证铁生锈的条件之一是 。
人类生活生产离不开金属,请回答下列问题:
(1)下列现象和事实,不可以用金属活动性做合理解释的是 (填序号)。
①金属镁在空气中比铝更容易燃烧,说明镁比铝的活动性强
②金属铝比金属锌更耐腐蚀,说明锌比铝活动性强
③用硫酸铜、石灰水配置农药波尔多液时,不能用铁制容器
④金属的种类很多,但在自然界中,仅有少数金属如金、银等有单质形式存在
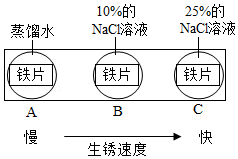
(2)某小组用如图所示装置对铁生锈的条件进行探究,四分钟后发现A中铁钉表面灰暗,B中铁钉依然光亮,对比A、B现象说明:决定铁生锈快慢的一个重要因素是 。
(3)实验室常用10%的稀盐酸除铁锈,再用浓盐酸配置10%稀盐酸的过程中,除了用到烧杯、量筒和胶头滴管外,还需要用到的仪器是 。
(4)请你设计实验验证铜和银的金属活动性顺序,用化学方程式表示为 。
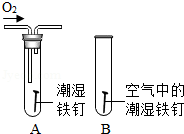
根据下列实验示意图回答问题:

(1)图A所示实验测定空气中氧气含量,可能导致的后果是 。
(2)图B所示实验探究铁锈蚀的条件,得到的实验结论是 。
(3)图C所示实验探究燃烧条件,观察到的现象是 。
(4)图D所示实验的目的是 。
(5)图E所示实验稀释浓硫酸,该实验的操作错误是 。
如图是初中化学教科书中的一些实验装置示意图。回答下列问题:
(1)A实验中,一段时间后可根据观察到 的现象,得出铁生锈需要与氧气接触的结论;
(2)B实验中,观察到薄铜片上的乒乓球碎片先燃烧,滤纸碎片后燃烧,可以说明燃烧条件之一是 ;
(3)C实验可得到的结论是 ;
(4)D实验中,向水中加少量硫酸钠或氢氧化钠的目的是 。
根据如图回答问题。

(1)A中仪器①的名称是 ,发生反应的化学方程式是 。
(2)B中木条变黑,说明浓硫酸具有 性。
(3)C中会出现明显现象的是试管 (填序号),试管Ⅱ中的蒸馏水需要煮沸、迅速冷却后再使用,目的是 。
如图是一些探究实验,请回答相关问题。
(1)A实验水中加入少量氢氧化钠溶液的作用是 。
(2)B实验中导致测量结果小于 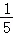 的原因可能是 (答一点即可)。
的原因可能是 (答一点即可)。
(3)C实验可验证二氧化碳的主要物理性质是 。
(4)D实验验证铁生锈的条件之一是 。
天然气(主要成分为CH4)作为清洁能源,正逐步走进城乡居民生活。
(1)“西气东输”工程利于国家能源和产业结构调整,极大改善了沿线居民生活质量。
①为防止传输天然气的钢管被腐蚀,可采取的措施有 (写出一种)。
②CH4完全燃烧的化学方程式是 ,该过程 (填“释放”或“吸收”)能量。
③天然气的使用可有效减少酸雨形成。下列现象与酸雨有关的是 。
A.石刻文物被腐蚀
B.全球海平面上升
(2)工业上以CH4为原料生产H2,制取原理如图所示:

已知变换塔、洗涤塔发生的主要反应依次是:CO+H2O CO2+H2,CO2+H2O═H2CO3。
CO2+H2,CO2+H2O═H2CO3。
①“转化炉”中有H2产生,参加反应的CH4与H2O的质量比 = 。
= 。
②“洗涤塔”中气体从塔底通入,水从塔顶喷淋。这样操作的优点是 。
③若有32g CH4参与反应(假设各步反应都完全转化),理论上可制得 g H2。
(3)我国是世界上首个成功试采海域可燃冰的国家。可燃冰是CH4被H2O分子形成的笼包裹,在海底低温和高压作用下形成的结晶物质。
①可燃冰样品常存放于液氮储存罐中,其原因是 。
②可燃冰有多种结构,某H型可燃冰的化学式为CH4•9H2O,分析其结构发现:平均34个H2O分子构成6个笼,每个笼只容纳一个CH4或H2O分子。这6个笼内容纳的CH4与H2O分子个数比是 (填最小整数比)。

试题篮
()